1 . 若 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.标准状况下,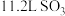 含有的分子数为 含有的分子数为 |
B.32g Cu在足量硫蒸气中完全反应失去的电子数为 |
C.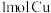 和含有 和含有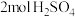 的浓硫酸反应,生成的 的浓硫酸反应,生成的 分子数目为 分子数目为 |
D.常温下,5.6g铁与硝酸反应,失去的电子数一定为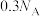 |
您最近半年使用:0次
2 . 将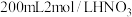 和
和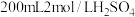 混合,若忽略溶液的体积变化,请计算:
混合,若忽略溶液的体积变化,请计算:
(1)该混合液最多可以溶解铜粉的质量为___________ g;(假设还原产物只有 )
)
(2)若想继续溶解更多铜粉到最大值,可以在该液体中继续加入 溶液
溶液___________  。
。
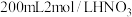 和
和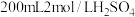 混合,若忽略溶液的体积变化,请计算:
混合,若忽略溶液的体积变化,请计算:(1)该混合液最多可以溶解铜粉的质量为
 )
)(2)若想继续溶解更多铜粉到最大值,可以在该液体中继续加入
 溶液
溶液 。
。
您最近半年使用:0次
名校
解题方法
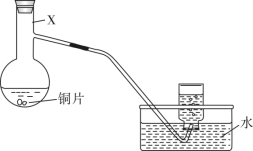
3 . 某小组利用如下装置(夹持装置略),探究浓、稀硝酸与铜反应的气体产物。回答下列问题:___________ 。
(2)请写出稀硝酸与铜反应的离子方程式___________ 。
(3)为节约药品用量,有人建议用具支试管(下图)代替仪器X,用试管代替集气瓶。为方便控制铜与硝酸反应的发生和停止,改进措施是___________ ;用改进后的装置进行铜与浓硝酸反应的实验,具支试管中产生的气体和排水收集到的气体___________ (填“相同”“不相同”)。 ,
, 仅得到一个
仅得到一个 ,稀硝酸与铜反应生成NO,
,稀硝酸与铜反应生成NO, 得到三个
得到三个 ,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较
,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较___________ ;角度二:同一种还原剂能被浓硝酸氧化,不能被稀硝酸氧化。根据角度二设计了如下装置,用以证明浓硝酸和稀硝酸的氧化性强弱关系。 ,目的是
,目的是___________ ;滴加浓硝酸后,当③中为稀硝酸时,其液面上方气体仍为无色;当③中为浓硝酸时,其液面上方气体由无色变为红棕色,反应的化学方程式为___________ 。
(5)有人提出(4)中角度二的验证实验不够简约,可将之前排水集气收集满NO的两支试管用橡胶塞塞紧,为防止气体逸出产生污染,在不取下胶塞的情况下向试管中分别加入稀硝酸、浓硝酸,简述其加入稀硝酸、浓硝酸的方法___________ 。
(2)请写出稀硝酸与铜反应的离子方程式
(3)为节约药品用量,有人建议用具支试管(下图)代替仪器X,用试管代替集气瓶。为方便控制铜与硝酸反应的发生和停止,改进措施是
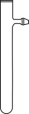
 ,
, 仅得到一个
仅得到一个 ,稀硝酸与铜反应生成NO,
,稀硝酸与铜反应生成NO, 得到三个
得到三个 ,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较
,但氧化性却是浓硝酸>稀硝酸。解释角度一:比较氧化剂的氧化性不是比较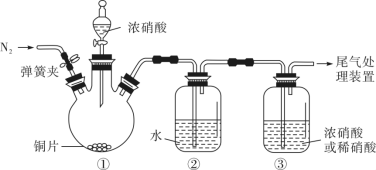
 ,目的是
,目的是(5)有人提出(4)中角度二的验证实验不够简约,可将之前排水集气收集满NO的两支试管用橡胶塞塞紧,为防止气体逸出产生污染,在不取下胶塞的情况下向试管中分别加入稀硝酸、浓硝酸,简述其加入稀硝酸、浓硝酸的方法
您最近半年使用:0次
名校
解题方法
4 . 某同学利用如图所示装置(夹持装置已省略)在通风橱内进行铜与稀硝酸反应的探究实验,下列说法错误的是
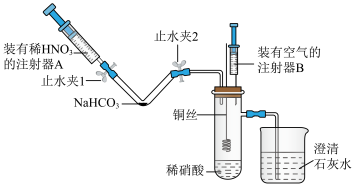
| A.注射器A中的稀硝酸与NaHCO3反应体现了硝酸的酸性 |
| B.当观察到澄清石灰水变浑浊后关闭止水夹1、2,将铜丝伸入稀硝酸中,观察到铜丝溶解,有无色气体产生 |
| C.铜与稀硝酸反应后,将注射器B中的空气注入具支试管,试管内气体会变成红棕色 |
| D.澄清石灰水可吸收挥发出来的NO,同时防止外界空气进入具支试管中干扰实验 |
您最近半年使用:0次
名校
解题方法
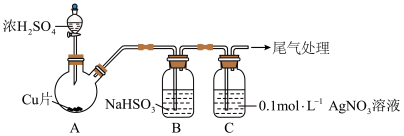
5 . 将足量SO2通入AgNO3溶液中,产生沉淀。探究反应原理及沉淀成分,装置如下(加热,夹持等装置略)。
资料:i.Ag2SO4微溶于水;Ag2SO3难溶于水。
ii.Ag2SO4、Ag2SO3均溶于氨水。___________ 。
②B的作用是___________ 。
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
推测白色沉淀(t1)可能为Ag2SO4、Ag2SO3或混合物。探究如下:
①试剂a是___________ 。
②产生白色沉淀Y的原因是___________ 。
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤,洗涤。向洗净的沉淀中加入浓HNO3,证实沉淀含Ag。现象是___________ 。
(4)通过检测 探究产生Ag的原因。
探究产生Ag的原因。
①实验:___________ 。(用化学方程式表示)
②t1时,C中产生白色沉淀的离子方程式是___________ 。
综上可知,化学反应的产物与反应速率有关。
资料:i.Ag2SO4微溶于水;Ag2SO3难溶于水。
ii.Ag2SO4、Ag2SO3均溶于氨水。
②B的作用是
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
| 时间 | 反应开始时(t1) | 一段时间后(t2) | 较长时间后(t3) |
| 颜色 | 白色 | 灰黑色 | 灰黑色加深 |

①试剂a是
②产生白色沉淀Y的原因是
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤,洗涤。向洗净的沉淀中加入浓HNO3,证实沉淀含Ag。现象是
(4)通过检测
 探究产生Ag的原因。
探究产生Ag的原因。①实验:
 (已排除O2的影响)
(已排除O2的影响)
②t1时,C中产生白色沉淀的离子方程式是
综上可知,化学反应的产物与反应速率有关。
您最近半年使用:0次
名校
6 . 下列不符合 环境保护和绿色化学理念的是
| A.用铜和浓硝酸反应制取Cu(NO3)2 |
B.在催化剂,400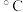 左右用NH3 与NO反应生成N2和H2O 左右用NH3 与NO反应生成N2和H2O |
| C.用银作催化剂,乙烯和氧气反应制取环氧乙烷,原子利用率100% |
| D.制CuSO4时先将Cu氧化成CuO后再与稀硫酸反应 |
您最近半年使用:0次
名校
解题方法
7 . 2.48g铁铜合金完全溶解于80mL 4.0 稀硝酸中,得到标准状况下672mL NO气体(假设此时无其他气体产生),下列说法正确的是
稀硝酸中,得到标准状况下672mL NO气体(假设此时无其他气体产生),下列说法正确的是
 稀硝酸中,得到标准状况下672mL NO气体(假设此时无其他气体产生),下列说法正确的是
稀硝酸中,得到标准状况下672mL NO气体(假设此时无其他气体产生),下列说法正确的是A.反应后溶液中不存在 |
| B.该合金中铁与铜的物质的量之比是1∶2 |
C.反应后溶液(忽略溶液体积变化)中 |
D.向反应后的溶液中加入2.0 NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120mL NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120mL |
您最近半年使用:0次
名校
解题方法
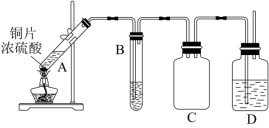
8 . 实验室研究不同价态元素的转化,对于物质的制备和应用至关重要。实验室可以用如下图所示装置研究S(+6价)→S(+4价)。______ 。
(2)装置C的作用是________ 。
(3)装置B用于检验装置A的气体产物,盛放试剂为_____ (填标号,下同),装置B中的现象是_____ 。装置D盛放的试剂为_____ ,写出该装置发生反应的的离子方程式_______ 。
a.BaCl2溶液 b.KI淀粉溶液 c.FeSO4溶液 d.NaOH溶液 e.品红溶液
(4)实验结束后,发现装置A中溶液几乎为无色,且试管中有较多的白色固体。试管中溶液显无色,体现了浓硫酸的_____ 性。
(5)实验结束后,若要证明装置A中白色固体为无水CuSO4,需要采取的操作是______ 。
(2)装置C的作用是
(3)装置B用于检验装置A的气体产物,盛放试剂为
a.BaCl2溶液 b.KI淀粉溶液 c.FeSO4溶液 d.NaOH溶液 e.品红溶液
(4)实验结束后,发现装置A中溶液几乎为无色,且试管中有较多的白色固体。试管中溶液显无色,体现了浓硫酸的
(5)实验结束后,若要证明装置A中白色固体为无水CuSO4,需要采取的操作是
您最近半年使用:0次
名校
9 . 在100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol·L-1,0.1mol·L-1,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中Cu2+的物质的量浓度(mol·L-1)是
| A.0.15 | B.0.45 | C.0.3 | D.0.225 |
您最近半年使用:0次
解题方法
10 . 研究硫及其化合物的应用价值对于社会发展意义重大。请回答以下问题。
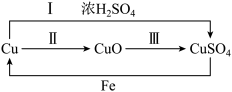
(1)下图为硫酸铜的制备和转化关系(反应条件略去):____ (选填写“强”或“弱”);
②为验证铜和浓硫酸反应生成的气体,将气体通入品红溶液,观察到的现象是_______ 。
③由上图可知,制备硫酸铜可以用途径甲(反应Ⅰ)或途径乙(反应Ⅱ+Ⅲ),从环保角度考虑,应选择途径______ (选填“甲”或“乙”),理由是_______ 。
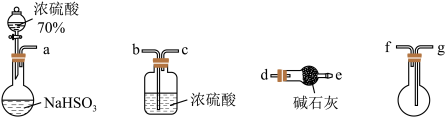
(2)用下图所示装置制备纯净的SO2(同时生成一种正盐),请写出发生装置中反应的化学方程式为______ ,装置的连接顺序为: a → _____ → e ( 按气流方向,用小写字母表示 ),碱石灰的主要作用为______ 。
(1)下图为硫酸铜的制备和转化关系(反应条件略去):
②为验证铜和浓硫酸反应生成的气体,将气体通入品红溶液,观察到的现象是
③由上图可知,制备硫酸铜可以用途径甲(反应Ⅰ)或途径乙(反应Ⅱ+Ⅲ),从环保角度考虑,应选择途径
(2)用下图所示装置制备纯净的SO2(同时生成一种正盐),请写出发生装置中反应的化学方程式为
您最近半年使用:0次



