名校
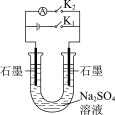
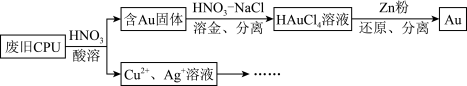
1 . 用如图方法回收废旧CPU中的单质 (金)、
(金)、 和
和 。
。 溶解。②
溶解。② :
:
(1)浓、稀 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:________ 。
(2) 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
①将溶金反应的化学方程式补充完整:_____ 
②关于溶金的下列说法正确的是_____ 。
A.用到了 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与 也可使
也可使 溶解
溶解
(3)若用 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为_____  。
。
(4)用适当浓度的盐酸、 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。_____ ,试剂2是_________ 。
 (金)、
(金)、 和
和 。
。
 溶解。②
溶解。② :
:(1)浓、稀
 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(2)
 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。①将溶金反应的化学方程式补充完整:

②关于溶金的下列说法正确的是
A.用到了
 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性C.用浓盐酸与
 也可使
也可使 溶解
溶解(3)若用
 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为 。
。(4)用适当浓度的盐酸、
 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。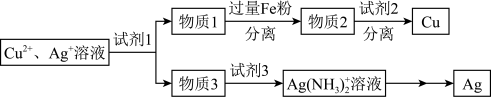
您最近一年使用:0次
名校
2 . 下列实验能达到实验目的的是
| A | B |
|
|
| 制作简单的燃料电池 | 证明苯环使羟基活化 |
| C | D |
|
|
制备并收集 | 检验溴乙烷的水解产物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-23更新
|
125次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
3 . 下列离子方程式书写正确的是
| A.铜与硝酸银溶液:Cu + 2Ag+ = Cu2++ 2Ag |
| B.氧化钠溶于水:Na2O + H2O = NaOH |
| C.盐酸溶液中加入铁粉:6H+ + 2Fe = 2Fe3+ + 3H2↑ |
D.碳酸钙和盐酸反应:CO + 2H+ = H2O + CO2↑ + 2H+ = H2O + CO2↑ |
您最近一年使用:0次
名校
4 . 下列叙述不正确 的是
| A.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量固体CuSO4,加快速率 |
| B.在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉溶解 |
| C.向FeCl3溶液中滴加氨水,产生红褐色沉淀;再加入NaHSO4溶液,沉淀消失 |
| D.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
您最近一年使用:0次
2023-10-15更新
|
193次组卷
|
2卷引用:北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题
解题方法
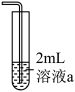
5 . 某小组同学探究铜和浓硝酸的反应,进行如下实验:
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
(1)写出铜和浓硝酸反应的离子反应方程式:______ 。
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:______ 。
(3)取⑤中溶液,______ (填操作和现象),证实猜想2成立。
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
结合上述实验现象,下列推测合理的是______ (填字母序号)。
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O HNO3+HNO2(慢)
HNO3+HNO2(慢)
反应2:2HNO2 NO2+NO+H2O(快)
NO2+NO+H2O(快)
解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因______ 。
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
①实验中加入的固体物质可能是______ (写出一种,填化学式)。
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,______ ,______ 。
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 铜粉质量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
| 溶液颜色 | 绿色 | 草绿色 | 蓝绿色偏绿 | 蓝绿色偏蓝 | 蓝色 |
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:
(3)取⑤中溶液,
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
| 通入气体 | 氮气 | 空气 |
| 现象 | 液面上方出现明显的红棕色气体,25min后溶液变为蓝色 | 液面上方出现明显的红棕色气体,5min后溶液变为蓝色 |
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O
 HNO3+HNO2(慢)
HNO3+HNO2(慢)反应2:2HNO2
 NO2+NO+H2O(快)
NO2+NO+H2O(快)解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
| 加入物质 | ______固体 | 3滴30%H2O2溶液 | 3滴水 |
| 现象 | 溶液绿色变深 | 溶液迅速变为蓝色 | 溶液颜色几乎不变 |
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,
您最近一年使用:0次
名校
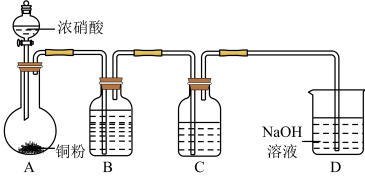
解题方法
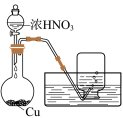
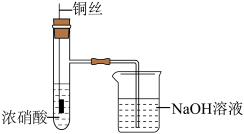
6 . 铜(过量)与浓硝酸反应,制备少量NaNO3,装置如下图所示。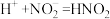 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮
(1)产生的红棕色气体是___________ 。
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)___________ c( )(填“>”或“<”)。
)(填“>”或“<”)。
②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是___________ 。
(3)NaOH溶液吸收NO2、NO。
①
___________
②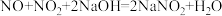
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是 、
、___________ (用化学方程式表示)。
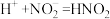 ,HNO2不稳定,易分解为硝酸和一氧化氮
,HNO2不稳定,易分解为硝酸和一氧化氮(1)产生的红棕色气体是
(2)一段时间后,试管中不再产生气体,静置。
①试管中溶液c(H+)
 )(填“>”或“<”)。
)(填“>”或“<”)。②滴加稀H2SO4,铜丝继续溶解,产生无色气体,反应的离子方程式是
(3)NaOH溶液吸收NO2、NO。
①

②
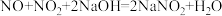
(4)向烧杯中加入稀HNO3,加热,搅拌,冷却结晶,过滤得NaNO3固体。稀HNO3的作用是
 、
、
您最近一年使用:0次
2023-07-13更新
|
144次组卷
|
2卷引用:北京朝阳区2022-2023学年高一下学期7月期末考试化学试题
7 . 化学小组同学用铜与过量浓硝酸反应制备 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。
(1)甲同学提出猜想:浓硝酸中溶解了生成的 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。
实验:向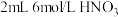 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。
甲同学进一步探究硝酸溶液中何种粒子与 作用显黄色。
作用显黄色。
①写出铜和浓硝酸反应产生 的化学方程式
的化学方程式___________ 。
②实验1中溶液a是___________ 。
③依据上述实验推知,浓硝酸中溶液 呈黄色是溶液中
呈黄色是溶液中___________ 与 作用的结果。
作用的结果。
(2)资料:ⅰ.铜与浓硝酸反应过程中可生成 ,
, 易分解产生无色气体
易分解产生无色气体
ⅱ. 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: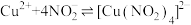 (绿色)
(绿色)
乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成 ,使溶液呈绿色。
,使溶液呈绿色。
实验4: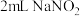 溶液与
溶液与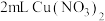 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。
丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应: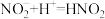 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。
猜想2:酸性条件下 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。
①补全 分解的化学方程式:□
分解的化学方程式:□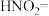 □
□ □___________+□___________
□___________+□______________________
②用离子方程式表示加入 溶液的作用
溶液的作用___________ 。
③丙同学依据实验推知猜想___________ (填“1”或“2”)成立。
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是___________ 。
 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。(1)甲同学提出猜想:浓硝酸中溶解了生成的
 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。实验:向
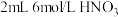 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。甲同学进一步探究硝酸溶液中何种粒子与
 作用显黄色。
作用显黄色。| 实验装置 | 操作 | 编号 | 溶液a | 现象 |
| 向溶液a中通入稳定的 气流8s 气流8s | 实验1 | ___________ | 溶液基本无色 |
| 实验2 | 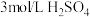 | 立即变黄 | ||
| 实验3 | 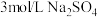 | 溶液基本无色 |
 的化学方程式
的化学方程式②实验1中溶液a是
③依据上述实验推知,浓硝酸中溶液
 呈黄色是溶液中
呈黄色是溶液中 作用的结果。
作用的结果。(2)资料:ⅰ.铜与浓硝酸反应过程中可生成
 ,
, 易分解产生无色气体
易分解产生无色气体ⅱ.
 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: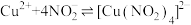 (绿色)
(绿色)乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成
 ,使溶液呈绿色。
,使溶液呈绿色。实验4:
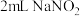 溶液与
溶液与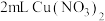 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应:
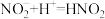 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。猜想2:酸性条件下
 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。| 将实验4中蓝色溶液分成两份 | 加入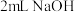 溶液,振荡 溶液,振荡 | 溶液变绿色 |
加入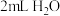 ,振荡 ,振荡 | 溶液仍为蓝色 |
 分解的化学方程式:□
分解的化学方程式:□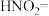 □
□ □___________+□___________
□___________+□___________②用离子方程式表示加入
 溶液的作用
溶液的作用③丙同学依据实验推知猜想
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是
您最近一年使用:0次
2023-07-11更新
|
220次组卷
|
3卷引用:北京市西城区2022-2023学年高一下学期期末测试化学试题
名校
解题方法
8 . 某学习小组探究稀 、浓
、浓 与铜的反应。
与铜的反应。
(1)试管Ⅰ中Cu与稀 反应的化学方程式是
反应的化学方程式是___________ 。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是___________ 。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1: 的浓度较大所致;
的浓度较大所致;
假设2:溶解了生成的 。
。
探究如下:取Ⅱ中绿色溶液,分为两等份。
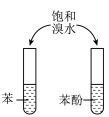
①取一份置于如图所示装置中,___________ (填“操作”和“现象”),证实Ⅱ中溶解了 。
。
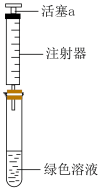
②向另一份溶液加入___________ (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀 与铜生成NO、浓
与铜生成NO、浓 与铜生成
与铜生成 的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
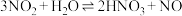
①B中盛放的试剂是___________ 。
②C中盛放 和
和___________ 。
③该小组证实推测的合理性所依据的实验现象是___________ 。
 、浓
、浓 与铜的反应。
与铜的反应。| 装置(尾气处理装置略) | 现象 |
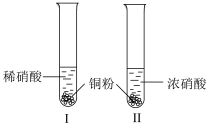 | Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
| Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
 反应的化学方程式是
反应的化学方程式是(2)Ⅱ中反应的速率比Ⅰ中的快,原因是
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:
 的浓度较大所致;
的浓度较大所致;假设2:溶解了生成的
 。
。探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份置于如图所示装置中,
 。
。
②向另一份溶液加入
(4)对于稀
 与铜生成NO、浓
与铜生成NO、浓 与铜生成
与铜生成 的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。

①B中盛放的试剂是
②C中盛放
 和
和③该小组证实推测的合理性所依据的实验现象是
您最近一年使用:0次
9 . 某研究小组对甲醛的性质进行推测和验证。
Ⅰ.性质推测:
同学甲认为,甲醛的性质应该与乙醛类似,在加热的条件下甲醛可以与新制Cu(OH)2悬浊液反应,且产物是Cu2O和甲酸钠。
(1)写出同学甲所预期的该反应的化学方程式___________ 。
Ⅱ.实验验证:
向3.5 mL新制氢氧化铜碱性悬浊液中加40%福尔马林溶液2mL,加热,有较多无色气
泡逸出。最终试管内所得红色沉淀与乙醛跟氢氧化铜悬浊液反应所得的固体颜色有所不同,试管内壁沉积了一层紫红色的固体物质。
同学甲分别对实验过程中产生的红色沉淀及气体的成分进行探究。
(2)取少量实验中所得的红色沉淀于试管中,加入适量浓氨水,振荡,溶液颜色无明显变化,静置数小时后,溶液颜色略呈浅蓝色,但试管底部红色沉淀的量变化不大。由此判断红色沉淀可能是___________ (写化学式)。用离子方程式解释溶液略呈浅蓝色的原因___________ 。
(3)为进一步验证上述结论,另取少量实验中所得的红色沉淀于试管,加入___________ 。
a.稀硫酸 b.稀硝酸 c.浓硝酸
若观察到___________ 的现象,可证明前面判断正确。
(4)同学甲认为无色气体可能是二氧化碳、甲醛或两者的混合气体。同学乙认为该气体中不可能含有二氧化碳,理由是___________ ,乙同学将产生的无色气体通入银氨溶液,水浴加热,试管壁上很快就有银镜形成。
同学们据此实验现象判断:无色气体的成分是甲醛。
(5)甲乙两同学进一步查阅资料,发现无色气体的主要成分也可能是CO。设计如下实验方案,进一步探究:

实验现象:氧化铜由黑变红、澄清石灰水变浑浊。
方案中水洗的目的是___________ 。
Ⅰ.性质推测:
同学甲认为,甲醛的性质应该与乙醛类似,在加热的条件下甲醛可以与新制Cu(OH)2悬浊液反应,且产物是Cu2O和甲酸钠。
(1)写出同学甲所预期的该反应的化学方程式
Ⅱ.实验验证:
向3.5 mL新制氢氧化铜碱性悬浊液中加40%福尔马林溶液2mL,加热,有较多无色气
泡逸出。最终试管内所得红色沉淀与乙醛跟氢氧化铜悬浊液反应所得的固体颜色有所不同,试管内壁沉积了一层紫红色的固体物质。
| 【资料】 ① 甲醛属于强还原剂,在碱性条件下还原性更强,在空气中能缓慢氧化成甲酸。 ② CO也能还原银氨溶液产生银镜。 ③ Cu2O在酸性溶液中能转化为Cu2+、Cu。 ④ Cu2O能溶于浓氨水形成无色配合物离子[Cu(NH3)2]+,并在空气中立即被氧化为蓝色的[Cu(NH3)4]2+。置于空气中,Cu也能缓慢溶于浓氨水生成蓝色的[Cu(NH3)4]2+。 |
(2)取少量实验中所得的红色沉淀于试管中,加入适量浓氨水,振荡,溶液颜色无明显变化,静置数小时后,溶液颜色略呈浅蓝色,但试管底部红色沉淀的量变化不大。由此判断红色沉淀可能是
(3)为进一步验证上述结论,另取少量实验中所得的红色沉淀于试管,加入
a.稀硫酸 b.稀硝酸 c.浓硝酸
若观察到
(4)同学甲认为无色气体可能是二氧化碳、甲醛或两者的混合气体。同学乙认为该气体中不可能含有二氧化碳,理由是
同学们据此实验现象判断:无色气体的成分是甲醛。
(5)甲乙两同学进一步查阅资料,发现无色气体的主要成分也可能是CO。设计如下实验方案,进一步探究:

实验现象:氧化铜由黑变红、澄清石灰水变浑浊。
方案中水洗的目的是
您最近一年使用:0次
名校
10 . 某同学研究铜与稀硝酸的反应,实验如下(夹持装置已略去,气密性良好)。
(1) 中的氮元素为
中的氮元素为 价,是氮元素的最高价态,
价,是氮元素的最高价态, 具有
具有___________ (填“氧化”或“还原”)性。
(2)步骤Ⅲ中分液漏斗内的红棕色气体是___________ 。
(3)写出铜与稀硝酸反应的化学方程式___________ 。
(4)上述实验过程中,有利于减少环境污染的措施有___________ (写出一条即可)。
| 步骤Ⅰ | 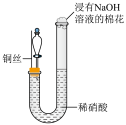 | 如图组装仪器并加入药品,分液漏斗旋塞关闭,U型管左侧无气体 |
| 步骤Ⅱ | 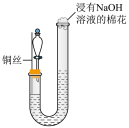 | 将铜丝下移,一段时间后,U型管左侧产生无色气体,溶液逐渐变蓝,当液面低于铜丝时,反应逐渐停止 |
| 步骤Ⅲ | 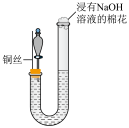 | 将铜丝上移,打开分液漏斗旋塞,U型管内气体进入分液漏斗立即变为红棕色,待气体全部进入分液漏斗后关闭旋塞 |
 中的氮元素为
中的氮元素为 价,是氮元素的最高价态,
价,是氮元素的最高价态, 具有
具有(2)步骤Ⅲ中分液漏斗内的红棕色气体是
(3)写出铜与稀硝酸反应的化学方程式
(4)上述实验过程中,有利于减少环境污染的措施有
您最近一年使用:0次