名校
解题方法
1 . 下列方程式不能 表示相应变化的是
A.氢氧化钾在水中电离: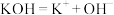 |
B.氯气与氢氧化钠溶液反应: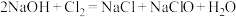 |
C.石灰石与稀盐酸反应: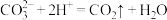 |
D.铜与浓硝酸反应: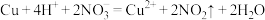 |
您最近一年使用:0次
2023-05-23更新
|
70次组卷
|
2卷引用:北京市回民学校2022-2023学年高一下学期期中考试化学试题
解题方法
2 . 某学习小组探究铜与稀 、浓
、浓 的反应。
的反应。
(1)Ⅰ中 与稀
与稀 反应的化学方程式是
反应的化学方程式是___________ 。
(2)Ⅱ中反应的速率比Ⅰ中快的原因是___________ 。
(3)针对Ⅱ中“溶液呈绿色”的原因,小组同学提出假设,并进行实验探究
假设1:___________ ;
假设2: 的浓度较大所致。
的浓度较大所致。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①甲同学取一份溶液于下图所示试管中,___________ (填“实验现象”),证实假设1成立。
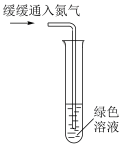
②乙同学向另一份溶液中加水稀释,溶液变为蓝色。乙同学的操作___________ (填“能”或“否”)证实假设2成立,结合化学用语说明理由___________ 。
(4)为了进一步解释Ⅰ和Ⅱ现象不同的原因,小组同学查阅资料:浓 氧化性强于稀
氧化性强于稀 。小组同学推测浓
。小组同学推测浓 能将
能将 氧化成
氧化成 ,稀
,稀 不能氧化
不能氧化 。并设计如下实验(实验前封闭装置内空气已除净)。
。并设计如下实验(实验前封闭装置内空气已除净)。
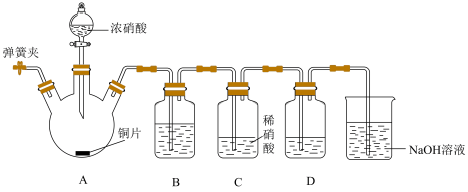
①装置B的作用是___________ 。
②装置D中盛放 和
和___________ 。
③小组同学若要证实推测成立,预计的实验现象是___________ 。
 、浓
、浓 的反应。
的反应。| 装置(尾气处理装置略) | 现象 |
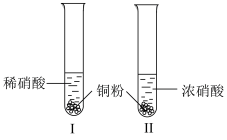 | Ⅰ中开始无明显现象,随后有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
| Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
 与稀
与稀 反应的化学方程式是
反应的化学方程式是(2)Ⅱ中反应的速率比Ⅰ中快的原因是
(3)针对Ⅱ中“溶液呈绿色”的原因,小组同学提出假设,并进行实验探究
假设1:
假设2:
 的浓度较大所致。
的浓度较大所致。探究如下:取Ⅱ中绿色溶液,分为两等份。
①甲同学取一份溶液于下图所示试管中,

②乙同学向另一份溶液中加水稀释,溶液变为蓝色。乙同学的操作
(4)为了进一步解释Ⅰ和Ⅱ现象不同的原因,小组同学查阅资料:浓
 氧化性强于稀
氧化性强于稀 。小组同学推测浓
。小组同学推测浓 能将
能将 氧化成
氧化成 ,稀
,稀 不能氧化
不能氧化 。并设计如下实验(实验前封闭装置内空气已除净)。
。并设计如下实验(实验前封闭装置内空气已除净)。
①装置B的作用是
②装置D中盛放
 和
和③小组同学若要证实推测成立,预计的实验现象是
您最近一年使用:0次
解题方法
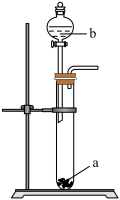
3 . 某小组同学用如下图所示装置进行铜与浓硫酸的反应,并探究产物的性质(气密性已检验、夹持装置已略去)。
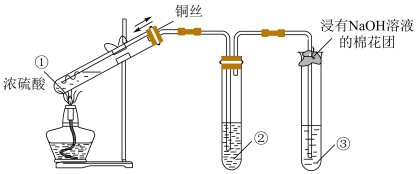
(1)试管①中反应的化学方程式是___________ ;浓硫酸表现出的性质是___________ 、___________ 。
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是___________ ;若试管②中的试剂为酸性 溶液,实验时②中溶液褪色,则说明①中生成的气体具有
溶液,实验时②中溶液褪色,则说明①中生成的气体具有___________ 性;若试管②中的试剂为 溶液,实验中观察到的现象是
溶液,实验中观察到的现象是___________ ,从化合价和物质性质的角度分析该反应发生的原因___________ 。
(3)试管③中的试剂为 溶液,其作用是吸收尾气,反应的离子方程式是
溶液,其作用是吸收尾气,反应的离子方程式是___________ 。
(4)为确认试管①中含铜物质的生成,小组同学需要进行的实验操作 是___________ 。

(1)试管①中反应的化学方程式是
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是
 溶液,实验时②中溶液褪色,则说明①中生成的气体具有
溶液,实验时②中溶液褪色,则说明①中生成的气体具有 溶液,实验中观察到的现象是
溶液,实验中观察到的现象是(3)试管③中的试剂为
 溶液,其作用是吸收尾气,反应的离子方程式是
溶液,其作用是吸收尾气,反应的离子方程式是(4)为确认试管①中含铜物质的生成,小组同学需要进行的实验
您最近一年使用:0次
解题方法
4 . 下列反应的离子方程式或化学方程式不正确 的是
A.硝酸银溶液与盐酸反应: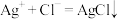 |
B.浓硝酸见光分解: |
C.铜与稀硝酸反应: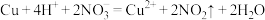 |
D.浓硫酸与红热的木炭反应: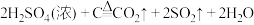 |
您最近一年使用:0次
名校
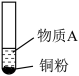
5 . 小组同学探究 和物质A的反应,实验如下。
和物质A的反应,实验如下。
下列分析不正确 的是
 和物质A的反应,实验如下。
和物质A的反应,实验如下。| 装置 | 序号 | 物质A | 实验现象 |
| ① | 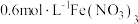 溶液(调 溶液(调 ) ) | 铜粉溶解,溶液变为深棕色[经检验含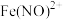 ] ] |
| ② | 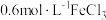 溶液 溶液 | 铜粉溶解,溶液变为蓝绿色 | |
| ③ | 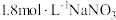 溶液(调 溶液(调 ) ) | 无明显变化 |
A.②中铜粉溶解的原因: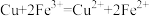 |
B.①中产生 的原因: 的原因: 时直接将 时直接将 还原为 还原为 |
C.若向③中加入 固体,推测铜粉会溶解 固体,推测铜粉会溶解 |
| D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关 |
您最近一年使用:0次
2023-05-07更新
|
1479次组卷
|
15卷引用:北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题
北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市第一○一中学2023-2024学年高三上学期10月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题(已下线)第7讲 金属材料和金属矿物利用(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题山东省青岛第二中学2023-2024学年高三上学期期中考试化学试卷北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题北京市第二中学2023-2024学年高三下学期开学考试化学试卷北京市八一学校2023-2024学年高一下学期3月月考化学试题(已下线)热点19 化学微型实验
名校
解题方法
6 . 某化学小组研究硝酸与金属的反应。下列实验中硝酸与金属的反应均在注射器中完成,实验操作及实验现象记录如表:
(1)铜与浓HNO3反应产生红棕色气体的化学方程式是___________ 。
(2)对实验1所得溶液呈绿色,而实验2所得溶液呈蓝色的原因提出猜想。
查阅资料:i.NO2溶于稀硝酸会反应;而溶于浓硝酸不反应,使溶液呈黄色;
ii.NO2与水反应时会有部分发生反应:2NO2 + H2O = HNO3 + HNO2,HNO2是弱酸,不稳定。
猜想一:NO2溶于浓硝酸,与蓝色Cu(NO3)2溶液混合而呈现绿色。
猜想二:HNO2电离出的NO 与Cu2+结合为Cu(NO2)
与Cu2+结合为Cu(NO2) (绿色)。
(绿色)。
① 向浓硝酸中通入NO2,溶液呈黄色,加入___________ (填试剂)后呈绿色,证实猜想一合理。
② 研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。
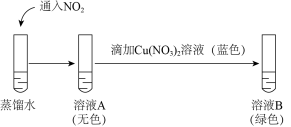
a.证明溶液A中含有HNO2的证据是___________ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是 实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
(3)实验2中充入O2后气体变为红棕色的反应的化学方程式是___________ 。
(4)查阅文献:铁粉与稀硝酸反应会生成H2。由实验3中的实验现象可知,过量的铁粉与0.5 mol/L稀HNO3反应的还原产物中除了H2外,还有___________ 生成。写出白色沉淀,迅速变为灰绿色,最后变成红褐色的化学方程式___________ 。
(5)甲同学对实验3产生H2的原因提出假设:该浓度的硝酸中 H+ 的氧化性大于NO 。乙同学认为该假设不合理。依据是实验2中观察到了
。乙同学认为该假设不合理。依据是实验2中观察到了___________ (填实验现象),该现象能说明假设不合理,理由是___________ 。
(6)结合以上实验可知,金属与硝酸反应的产物与___________ 等因素有关。
| 序号 | 实验操作与实验现象 |
| 实验1 | 加入过量的铜片与2mL的浓硝酸。反应剧烈,产生红棕色气体,溶液立即呈绿色。 |
| 实验2 | 加入过量的铜片与2 mL 0.5 mol/L HNO3溶液。产生无色气泡,溶液逐渐变为蓝色。注射器中的气体始终无色。反应结束后,向注射器中充入一定量的O2,气体迅速变为红棕色 |
| 实验3 | 加入过量的铁粉与2 mL 0.5 mol/L HNO3溶液,立即有无色气体生成,溶液为很浅的绿色,反应结束后将气体通入有空气的容器无明显变化,点燃,有尖锐的爆鸣声,容器壁出现无色液滴;取反应后溶液,加入足量NaOH溶液,立刻得到白色沉淀,迅速变为灰绿色,最后变成红褐色,加热后产生能使湿润红色石蕊试纸变蓝的气体。 |
(2)对实验1所得溶液呈绿色,而实验2所得溶液呈蓝色的原因提出猜想。
查阅资料:i.NO2溶于稀硝酸会反应;而溶于浓硝酸不反应,使溶液呈黄色;
ii.NO2与水反应时会有部分发生反应:2NO2 + H2O = HNO3 + HNO2,HNO2是弱酸,不稳定。
猜想一:NO2溶于浓硝酸,与蓝色Cu(NO3)2溶液混合而呈现绿色。
猜想二:HNO2电离出的NO
 与Cu2+结合为Cu(NO2)
与Cu2+结合为Cu(NO2) (绿色)。
(绿色)。① 向浓硝酸中通入NO2,溶液呈黄色,加入
② 研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

a.证明溶液A中含有HNO2的证据是
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二
(3)实验2中充入O2后气体变为红棕色的反应的化学方程式是
(4)查阅文献:铁粉与稀硝酸反应会生成H2。由实验3中的实验现象可知,过量的铁粉与0.5 mol/L稀HNO3反应的还原产物中除了H2外,还有
(5)甲同学对实验3产生H2的原因提出假设:该浓度的硝酸中 H+ 的氧化性大于NO
 。乙同学认为该假设不合理。依据是实验2中观察到了
。乙同学认为该假设不合理。依据是实验2中观察到了(6)结合以上实验可知,金属与硝酸反应的产物与
您最近一年使用:0次
名校
7 . 根据如图所示装置进行实验,能得到相应结论的是。
| 试剂a、b | 现象 | 结论 | 装置 | |
| A |  、稀 、稀 | 产生的无色气体在导管口变红棕色 |  和稀 和稀 反应生成 反应生成 |
|
| B | 漂白粉、浓 | 导管口放置的湿润蓝色石蕊试纸先变红后褪色。 | 漂白粉和浓 反应生成 反应生成 | |
| C |  、75%酒精溶液 、75%酒精溶液 | 收集产生的气体,移近火焰,发出爆鸣声 |  和 和 反应生成 反应生成 | |
| D | 电石、饱和食盐水 | 产生的气体使酸性高锰酸钾溶液褪色 |  和 和 反应生成 反应生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-06更新
|
457次组卷
|
4卷引用:北京市海淀区2022-2023学年高三下学期期中练习化学试题
名校
解题方法
8 . 下列关于铜腐蚀的说法及方程式书写正确的是
A.铜在潮湿空气中被腐蚀: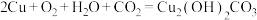 |
B.铜在 环境中被腐蚀: 环境中被腐蚀: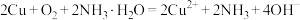 |
C. 浓度越大,腐蚀反应 浓度越大,腐蚀反应 速率越大 速率越大 |
D.利用 对铜的腐蚀制作印刷线路板: 对铜的腐蚀制作印刷线路板: |
您最近一年使用:0次
2023-03-30更新
|
630次组卷
|
4卷引用:北京市朝阳区2023届高三一模考试化学试题
名校
解题方法
9 . 在标准状况下将3.2g铜粉投入一定量浓 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为| A.112mL | B.224mL | C.448mL | D.1008mL |
您最近一年使用:0次
2023-03-21更新
|
437次组卷
|
8卷引用:北京师范大学附属中学2022-2023学年高一下学期期中考试化学试题
北京师范大学附属中学2022-2023学年高一下学期期中考试化学试题北京师范大学附属中学2020-2021学年高一下学期期中考试化学(选考班)试题北京师范大学附属中学2021-2022学年高一下学期期中考试化学试题江西省南昌市第十中学2022—2023学年高一下学期第一次月考化学试题(已下线)专题01 金属及其化合物(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)(已下线)期中模拟题(一)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)北京市东直门中学2023-2024学年高一下学期3月学情监测化学试题天津市滨海新区塘沽第一中学2023-2024学年高一下学期第一次月考化学试卷
名校
10 . 下列解释事实的方程式不正确的是
A.石英砂获得粗硅的化学方程式为:SiO2+2C Si+2CO↑ Si+2CO↑ |
B.铜与稀硝酸反应:Cu+4H++2NO =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
C.保存NaOH溶液的试剂瓶用橡胶塞不用玻璃塞的原因是:SiO2+2OH-=SiO +H2O +H2O |
D.浓硫酸与红热的木炭反应:2H2SO4(浓)+C CO2↑+2SO2↑+2H2O CO2↑+2SO2↑+2H2O |
您最近一年使用:0次