名校
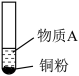
1 . 小组同学探究 和物质A的反应,实验如下。
和物质A的反应,实验如下。
下列分析不正确 的是
 和物质A的反应,实验如下。
和物质A的反应,实验如下。| 装置 | 序号 | 物质A | 实验现象 |
| ① | 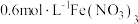 溶液(调 溶液(调 ) ) | 铜粉溶解,溶液变为深棕色[经检验含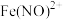 ] ] |
| ② | 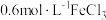 溶液 溶液 | 铜粉溶解,溶液变为蓝绿色 | |
| ③ | 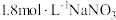 溶液(调 溶液(调 ) ) | 无明显变化 |
A.②中铜粉溶解的原因: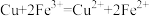 |
B.①中产生 的原因: 的原因: 时直接将 时直接将 还原为 还原为 |
C.若向③中加入 固体,推测铜粉会溶解 固体,推测铜粉会溶解 |
| D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关 |
您最近一年使用:0次
2023-05-07更新
|
1419次组卷
|
15卷引用:北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题
北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市第一○一中学2023-2024学年高三上学期10月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题北京市第二中学2023-2024学年高三下学期开学考试化学试卷北京市八一学校2023-2024学年高一下学期3月月考化学试题(已下线)第7讲 金属材料和金属矿物利用(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题山东省青岛第二中学2023-2024学年高三上学期期中考试化学试卷(已下线)热点19 化学微型实验
解题方法
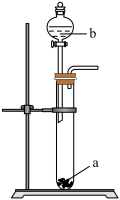
2 . 某化学小组探究铜和稀硝酸的反应:
资料1 铜与浓度低于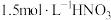 反应很慢,且放热极少。
反应很慢,且放热极少。
(1)实验预测
①铜与稀 反应的离子方程式为
反应的离子方程式为_______ 。
②小组同学预测铜与稀 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是_______ 。
(2)实验实施
实验I:铜丝与 反应。
反应。
实验II:探究Cu与稀 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:
资料2:
i.上述溶液中均不存在-3价的氮; 为淡黄色沉淀。
为淡黄色沉淀。
ii. 是一种弱酸,
是一种弱酸, ;
;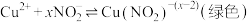
①通过上述实验,证明铜与稀 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是_______ 。
②分析阶段B溶液呈绿色的原因_______ 。
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因_______ 。
④写出铜和稀 反应的生成
反应的生成 的化学方程式
的化学方程式_______ 。
(3)继续探究:
探究铜和稀 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
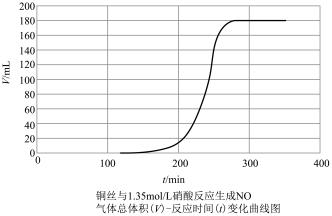
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为_______ 。
(4)反思总结:通过上述实验探究过程,铜和 的反应实际过程可能为
的反应实际过程可能为_______ 。
资料1 铜与浓度低于
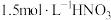 反应很慢,且放热极少。
反应很慢,且放热极少。(1)实验预测
①铜与稀
 反应的离子方程式为
反应的离子方程式为②小组同学预测铜与稀
 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是(2)实验实施
实验I:铜丝与
 反应。
反应。| 实验装置 | 实验操作 | 实验现象 |
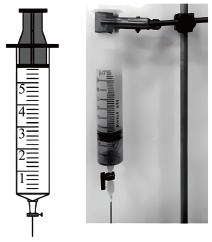 | 在洁净的注射器中装入已活化铜丝2.3g,再用注射器抽取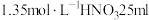 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 反应体系处于无氧环境中。 反应体系处于无氧环境中。 | 反应较慢阶段A:反应前90min几乎没有现象,90min左右才有很少气泡产生(该气体遇空气变成红棕色),溶液为浅蓝色;反应较快阶段B:之后溶液逐渐变为绿色;最后阶段C:在反应结束前15min左右时,体系溶液为深蓝色。 |
 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:操作及现象 实验序号 | 取不同阶段的溶液进行实验操作 | 实验现象 | ||
| 阶段A溶液 | 阶段B溶液 | 阶段C溶液 | ||
| 1 | 滴加 酸性 酸性 溶液 溶液 | 褪色,滴6滴后溶液不褪色 | 褪色,但滴20滴后溶液仍然褪色 | 褪色,滴10滴后溶液不再褪色 |
| 2 | 滴加3% 溶液 溶液 | 无明显现象 | 少量淡黄色沉淀 | 较多黄色沉淀 |
| 3 | 滴加稀 溶液 溶液 | 无明显现象 | 变蓝色 | 无明显现象 |
i.上述溶液中均不存在-3价的氮;
 为淡黄色沉淀。
为淡黄色沉淀。ii.
 是一种弱酸,
是一种弱酸, ;
;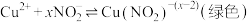
①通过上述实验,证明铜与稀
 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是②分析阶段B溶液呈绿色的原因
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因
④写出铜和稀
 反应的生成
反应的生成 的化学方程式
的化学方程式(3)继续探究:
探究铜和稀
 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物
 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为(4)反思总结:通过上述实验探究过程,铜和
 的反应实际过程可能为
的反应实际过程可能为
您最近一年使用:0次
2023-01-09更新
|
763次组卷
|
4卷引用:北京市顺义区2023届高三第一次统练化学试题
名校
3 . 硝酸是一种重要的化工原料。
(1)在浓硝酸中加入铜片,开始反应时有红棕色气体产生,写出发生反应的离子方程式_______ ;反应停止后,仍有铜剩余,加入20%的稀硫酸,铜片上又有气泡产生,稀硫酸的作用是_______ (填字母)。
A.还原剂 B.氧化剂 C.酸化 D.提供热能
(2)实验小组用稀硝酸和铜分别设计了甲、乙两组实验(装置如图所示,夹持仪器已略去)。
①甲组实验中,同学们观察到集气瓶中收集到无色气体。部分同学认为该实验不能确定是铜与稀硝酸反应生成了 ,因为集气瓶中无色气体的来源可能是
,因为集气瓶中无色气体的来源可能是_______ 。
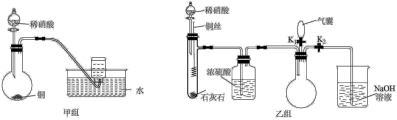
②乙组实验的操作步骤是:
a.关闭活塞 ,打开活塞
,打开活塞 ,将过量稀硝酸加入石灰石中。该操作的目的是
,将过量稀硝酸加入石灰石中。该操作的目的是_______ 。
b.待石灰石反应完全后,将铜丝插入过量稀硝酸中。
c.一段时间后,欲证明圆底烧瓶中收集列的无色气体是 ,应进行的操作是
,应进行的操作是_______ ,观察到的现象是_______ 。
(3)某些资料认为 不能与
不能与 反应。某同学提出质疑,他认为
反应。某同学提出质疑,他认为 易与
易与 发生反应,应该更容易被
发生反应,应该更容易被 氧化。
氧化。
查阅资料:a.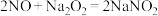 ;
;
b.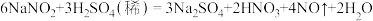
c.酸性条件下, 能被
能被 氧化生成
氧化生成 。
。
该同学在乙组实验的基础上,用如图所示装置探究 与
与 的反成。
的反成。
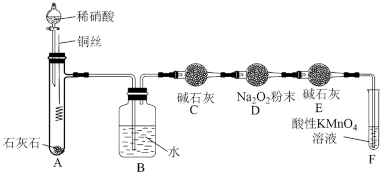
①C装置中碱石灰的作用是_______ ;F装置中反应的离子方程式为_______ 。
②充分反应后,检验D装置中是否发生反应a的实验操作及现象是_______ 。
(1)在浓硝酸中加入铜片,开始反应时有红棕色气体产生,写出发生反应的离子方程式
A.还原剂 B.氧化剂 C.酸化 D.提供热能
(2)实验小组用稀硝酸和铜分别设计了甲、乙两组实验(装置如图所示,夹持仪器已略去)。
①甲组实验中,同学们观察到集气瓶中收集到无色气体。部分同学认为该实验不能确定是铜与稀硝酸反应生成了
 ,因为集气瓶中无色气体的来源可能是
,因为集气瓶中无色气体的来源可能是
②乙组实验的操作步骤是:
a.关闭活塞
 ,打开活塞
,打开活塞 ,将过量稀硝酸加入石灰石中。该操作的目的是
,将过量稀硝酸加入石灰石中。该操作的目的是b.待石灰石反应完全后,将铜丝插入过量稀硝酸中。
c.一段时间后,欲证明圆底烧瓶中收集列的无色气体是
 ,应进行的操作是
,应进行的操作是(3)某些资料认为
 不能与
不能与 反应。某同学提出质疑,他认为
反应。某同学提出质疑,他认为 易与
易与 发生反应,应该更容易被
发生反应,应该更容易被 氧化。
氧化。查阅资料:a.
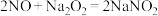 ;
;b.
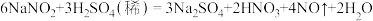
c.酸性条件下,
 能被
能被 氧化生成
氧化生成 。
。该同学在乙组实验的基础上,用如图所示装置探究
 与
与 的反成。
的反成。
①C装置中碱石灰的作用是
②充分反应后,检验D装置中是否发生反应a的实验操作及现象是
您最近一年使用:0次
2022-02-21更新
|
874次组卷
|
2卷引用:北京市第一六一中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
4 . 下列关于铜腐蚀的说法及方程式书写正确的是
A.铜在潮湿空气中被腐蚀: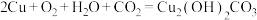 |
B.铜在 环境中被腐蚀: 环境中被腐蚀: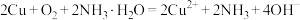 |
C. 浓度越大,腐蚀反应 浓度越大,腐蚀反应 速率越大 速率越大 |
D.利用 对铜的腐蚀制作印刷线路板: 对铜的腐蚀制作印刷线路板: |
您最近一年使用:0次
2023-03-30更新
|
623次组卷
|
4卷引用:北京市朝阳区2023届高三一模考试化学试题
名校
5 . 下列解释事实的方程式正确的是
A.利用铝热反应焊接钢轨: |
B.铜与稀硝酸反应: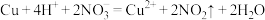 |
C.氯化铁溶液刻蚀铜电路板: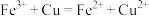 |
D.钠放入水中产生大量气体: |
您最近一年使用:0次
2022-04-04更新
|
677次组卷
|
5卷引用:北京市一零一中学2021-2022学年高一上学期期末考试化学试题
名校
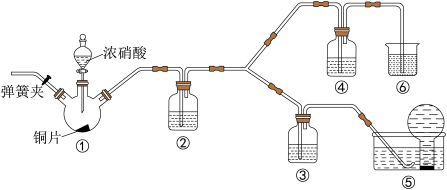
6 . 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______ 。
(2)装置①中发生反应的化学方程式是_______ 。
(3)装置②的作用是_______ ,发生反应的化学方程式是________ 。
(4)该小组得出的结论所依据的实验现象是_______ 。
(5)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是_______ (填字母)。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)装置①中发生反应的化学方程式是
(3)装置②的作用是
(4)该小组得出的结论所依据的实验现象是
(5)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
您最近一年使用:0次
名校
解题方法
7 . 实验小组研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ、Ⅱ中的红棕色气体均是 。
。
①实验Ⅰ产生 的化学方程式是
的化学方程式是_______ 。
②实验Ⅱ产生 的化学方程式是
的化学方程式是_______ 。
(2)对实验Ⅰ产生 ,实验Ⅱ产生
,实验Ⅱ产生 的原因提出解释。
的原因提出解释。
①硝酸浓度越稀,溶液中单位体积内的 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越_______ (填“大”或“小”),因此越易被还原为较低价态的含氮物质。
②浓硝酸具有较强的_______ 性,可将 转化为
转化为 。
。
(3)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:ⅰ. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ⅱ.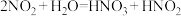 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是_______ ,滴加少量蓝色 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

a.能说明溶液A中含有 的现象是
的现象是_______ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:_______ 。
| 装置 | 编号 | 试剂a | 现象 |
 | Ⅰ | 4 浓硝酸 (过量) 浓硝酸 (过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体 |
| Ⅱ | 4 稀硝酸 (过量) 稀硝酸 (过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色 |
 。
。①实验Ⅰ产生
 的化学方程式是
的化学方程式是②实验Ⅱ产生
 的化学方程式是
的化学方程式是(2)对实验Ⅰ产生
 ,实验Ⅱ产生
,实验Ⅱ产生 的原因提出解释。
的原因提出解释。①硝酸浓度越稀,溶液中单位体积内的
 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越②浓硝酸具有较强的
 转化为
转化为 。
。(3)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:ⅰ.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ⅱ.
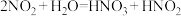 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

a.能说明溶液A中含有
 的现象是
的现象是b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
2022-07-10更新
|
686次组卷
|
2卷引用:北京朝阳区2021-2022学年高一下学期期末考试化学试题
名校
解题方法
8 . 同学们探究不同金属和浓硫酸的反应。向三等份浓硫酸中分别加入大小相同的不同金属片,加热,用生成气体进行下表实验操作并记录实验现象。
已知: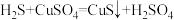 (CuS为黑色固体);
(CuS为黑色固体); 可燃
可燃
下列说法不正确 的是
| 实验操作 | 实验现象 | ||
| 金属为铜 | 金属为锌 | 金属为铝 | |
| 点燃 | 不燃烧 | 燃烧 | 燃烧 |
通入 酸性溶液 酸性溶液 | 褪色 | 褪色 | 褪色 |
通入 溶液 溶液 | 无明显变化 | 无明显变化 | 出现黑色沉淀 |
| 通入品红溶液 | 褪色 | 褪色 | 不褪色 |
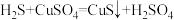 (CuS为黑色固体);
(CuS为黑色固体); 可燃
可燃下列说法
A.加入铜片的实验中,使 酸性溶液褪色的气体是 酸性溶液褪色的气体是 |
B.加入铝片的实验中,燃烧现象能证明生成气体中一定含 |
| C.加入锌片的实验中,生成的气体一定是混合气体 |
| D.金属与浓硫酸反应的还原产物与金属活动性强弱有关 |
您最近一年使用:0次
2021-05-10更新
|
1527次组卷
|
16卷引用:北京市海淀区2021届高三二模化学试题
北京市海淀区2021届高三二模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(02)北京首都师范大学附属中学2021-2022学年高三上学期10月月考化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京市房山区2022-2023学年高三二模化学试题北京市中国人民大学附属中学2023-2024学年高三下学期一模模拟化学试题北京市第八十中学2023-2024学年高一下学期期中考试化学(选考)试题(已下线)第13讲 硫及其化合物(精练)-2022年高考化学一轮复习讲练测(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练辽宁省沈阳市东北育才学校2021-2022学年高三上学期学段考试化学试题趋势4 创新探究类实验(已下线)第四章 非金属及其化合物 第21练 硫酸 含硫物质的转化广东省广州市番禺中学2022-2023学年高一下学期4月期中考试化学试题云南省昆明市第一中学2022-2023学年高一下学期期中考试化学试题(已下线)第4讲 浓硫酸 不同价态含硫物质的转化
名校
解题方法
9 . 在标准状况下将3.2g铜粉投入一定量浓 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为| A.112mL | B.224mL | C.448mL | D.1008mL |
您最近一年使用:0次
2023-03-21更新
|
432次组卷
|
8卷引用:北京师范大学附属中学2020-2021学年高一下学期期中考试化学(选考班)试题
北京师范大学附属中学2020-2021学年高一下学期期中考试化学(选考班)试题北京师范大学附属中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属中学2022-2023学年高一下学期期中考试化学试题北京市东直门中学2023-2024学年高一下学期3月学情监测化学试题江西省南昌市第十中学2022—2023学年高一下学期第一次月考化学试题(已下线)专题01 金属及其化合物(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)(已下线)期中模拟题(一)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)天津市滨海新区塘沽第一中学2023-2024学年高一下学期第一次月考化学试卷
名校
10 . 根据如图所示装置进行实验,能得到相应结论的是。
| 试剂a、b | 现象 | 结论 | 装置 | |
| A |  、稀 、稀 | 产生的无色气体在导管口变红棕色 |  和稀 和稀 反应生成 反应生成 |
|
| B | 漂白粉、浓 | 导管口放置的湿润蓝色石蕊试纸先变红后褪色。 | 漂白粉和浓 反应生成 反应生成 | |
| C |  、75%酒精溶液 、75%酒精溶液 | 收集产生的气体,移近火焰,发出爆鸣声 |  和 和 反应生成 反应生成 | |
| D | 电石、饱和食盐水 | 产生的气体使酸性高锰酸钾溶液褪色 |  和 和 反应生成 反应生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-06更新
|
450次组卷
|
4卷引用:北京市海淀区2022-2023学年高三下学期期中练习化学试题