名校
解题方法
1 . 在标准状况下将3.2g铜粉投入一定量浓 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
 中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由
中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由 和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为
和NO组成的混合气体1.344L(已转化为标况下的体积),则混合气体中NO的体积为| A.112mL | B.224mL | C.448mL | D.1008mL |
您最近一年使用:0次
2023-03-21更新
|
433次组卷
|
8卷引用:北京师范大学附属中学2020-2021学年高一下学期期中考试化学(选考班)试题
北京师范大学附属中学2020-2021学年高一下学期期中考试化学(选考班)试题北京师范大学附属中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属中学2022-2023学年高一下学期期中考试化学试题北京市东直门中学2023-2024学年高一下学期3月学情监测化学试题江西省南昌市第十中学2022—2023学年高一下学期第一次月考化学试题(已下线)专题01 金属及其化合物(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)(已下线)期中模拟题(一)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)天津市滨海新区塘沽第一中学2023-2024学年高一下学期第一次月考化学试卷
名校
2 . 下列解释事实的方程式不正确的是
A.石英砂获得粗硅的化学方程式为:SiO2+2C Si+2CO↑ Si+2CO↑ |
B.铜与稀硝酸反应:Cu+4H++2NO =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
C.保存NaOH溶液的试剂瓶用橡胶塞不用玻璃塞的原因是:SiO2+2OH-=SiO +H2O +H2O |
D.浓硫酸与红热的木炭反应:2H2SO4(浓)+C CO2↑+2SO2↑+2H2O CO2↑+2SO2↑+2H2O |
您最近一年使用:0次
解题方法
3 . 下列离子方程式书写正确的是
| A.FeCl3腐蚀Cu电路板:2Fe3++Cu=2Fe2++Cu2+ |
B.铜与稀硝酸反应:Cu+4H++NO =Cu2++NO2↑+2H2O =Cu2++NO2↑+2H2O |
C.碳酸钙溶于盐酸中:CO +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| D.氯气通入水中:Cl2+H2O=2H++Cl﹣+ClO﹣ |
您最近一年使用:0次
名校
解题方法
4 . 对于1 L  和
和 的混合溶液,若
的混合溶液,若 和
和 物质的量浓度存在如下关系:
物质的量浓度存在如下关系: ,理论上最多能溶解铜的物质的量为
,理论上最多能溶解铜的物质的量为
 和
和 的混合溶液,若
的混合溶液,若 和
和 物质的量浓度存在如下关系:
物质的量浓度存在如下关系: ,理论上最多能溶解铜的物质的量为
,理论上最多能溶解铜的物质的量为| A.0.9 mol | B.0.8 mol | C.0.45 mol | D.0.40 mol |
您最近一年使用:0次
名校
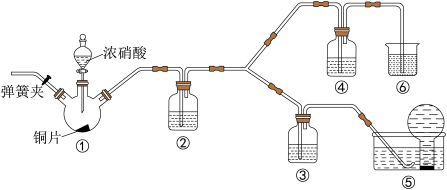
5 . 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_______ 。
(2)装置①中发生反应的化学方程式是_______ 。
(3)装置②的作用是_______ ,发生反应的化学方程式是________ 。
(4)该小组得出的结论所依据的实验现象是_______ 。
(5)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是_______ (填字母)。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)装置①中发生反应的化学方程式是
(3)装置②的作用是
(4)该小组得出的结论所依据的实验现象是
(5)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
您最近一年使用:0次
解题方法
6 . 某化学小组探究铜和稀硝酸的反应:
资料1 铜与浓度低于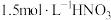 反应很慢,且放热极少。
反应很慢,且放热极少。
(1)实验预测
①铜与稀 反应的离子方程式为
反应的离子方程式为_______ 。
②小组同学预测铜与稀 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是_______ 。
(2)实验实施
实验I:铜丝与 反应。
反应。
实验II:探究Cu与稀 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:
资料2:
i.上述溶液中均不存在-3价的氮; 为淡黄色沉淀。
为淡黄色沉淀。
ii. 是一种弱酸,
是一种弱酸, ;
;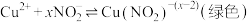
①通过上述实验,证明铜与稀 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是_______ 。
②分析阶段B溶液呈绿色的原因_______ 。
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因_______ 。
④写出铜和稀 反应的生成
反应的生成 的化学方程式
的化学方程式_______ 。
(3)继续探究:
探究铜和稀 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
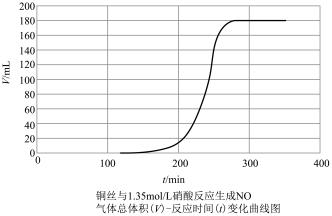
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为_______ 。
(4)反思总结:通过上述实验探究过程,铜和 的反应实际过程可能为
的反应实际过程可能为_______ 。
资料1 铜与浓度低于
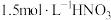 反应很慢,且放热极少。
反应很慢,且放热极少。(1)实验预测
①铜与稀
 反应的离子方程式为
反应的离子方程式为②小组同学预测铜与稀
 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是(2)实验实施
实验I:铜丝与
 反应。
反应。| 实验装置 | 实验操作 | 实验现象 |
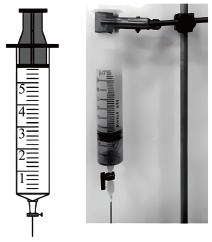 | 在洁净的注射器中装入已活化铜丝2.3g,再用注射器抽取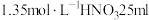 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 反应体系处于无氧环境中。 反应体系处于无氧环境中。 | 反应较慢阶段A:反应前90min几乎没有现象,90min左右才有很少气泡产生(该气体遇空气变成红棕色),溶液为浅蓝色;反应较快阶段B:之后溶液逐渐变为绿色;最后阶段C:在反应结束前15min左右时,体系溶液为深蓝色。 |
 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:操作及现象 实验序号 | 取不同阶段的溶液进行实验操作 | 实验现象 | ||
| 阶段A溶液 | 阶段B溶液 | 阶段C溶液 | ||
| 1 | 滴加 酸性 酸性 溶液 溶液 | 褪色,滴6滴后溶液不褪色 | 褪色,但滴20滴后溶液仍然褪色 | 褪色,滴10滴后溶液不再褪色 |
| 2 | 滴加3% 溶液 溶液 | 无明显现象 | 少量淡黄色沉淀 | 较多黄色沉淀 |
| 3 | 滴加稀 溶液 溶液 | 无明显现象 | 变蓝色 | 无明显现象 |
i.上述溶液中均不存在-3价的氮;
 为淡黄色沉淀。
为淡黄色沉淀。ii.
 是一种弱酸,
是一种弱酸, ;
;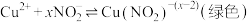
①通过上述实验,证明铜与稀
 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是②分析阶段B溶液呈绿色的原因
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因
④写出铜和稀
 反应的生成
反应的生成 的化学方程式
的化学方程式(3)继续探究:
探究铜和稀
 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物
 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为(4)反思总结:通过上述实验探究过程,铜和
 的反应实际过程可能为
的反应实际过程可能为
您最近一年使用:0次
2023-01-09更新
|
763次组卷
|
4卷引用:北京市顺义区2023届高三第一次统练化学试题
解题方法
7 . 解释下列事实所用的化学用语不正确 的是
A.酚酞滴入 溶液中,溶液变红: 溶液中,溶液变红: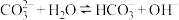 |
B.铜片放入浓硝酸中,产生红棕色气体: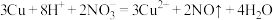 |
C.钢铁发生吸氧腐蚀,负极反应: |
D. 通入溴水中,溶液褪色: 通入溴水中,溶液褪色: |
您最近一年使用:0次
解题方法
8 . 某实验小组探究 与
与 溶液的反应。取
溶液的反应。取 铜粉加入
铜粉加入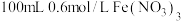 溶液(用
溶液(用 调
调 )中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
已知: 是难溶于水的白色固体
是难溶于水的白色固体
(1)预测铜粉可能发生的反应
反应I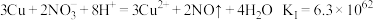
反应II__________________________ 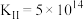
(2)探究反应I是否发生
①取 铜粉加入
铜粉加入
_____________ 溶液中,振荡、静置30分钟,无明显现象。(所用试剂:硝酸钠和硝酸溶液)
②用传感器检测 与
与 溶液反应过程中
溶液反应过程中 浓度的变化,发现
浓度的变化,发现 浓度逐渐减少。有同学认为:
浓度逐渐减少。有同学认为: 催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
ⅰ._____________
ⅱ.反应II
总反应: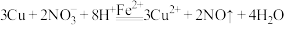
(3)探究反应II是否发生
取 铜粉加入
铜粉加入_____________ 中,溶液迅速变为蓝绿色。取上层清液,滴加 溶液,出现白色浑浊且溶液变红,振荡后红色褪去,
溶液,出现白色浑浊且溶液变红,振荡后红色褪去, 溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因
溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因_____________ 。
(4)分析“溶液呈棕绿色,未见有气泡产生”的原因
小组讨论认为,棕绿色可能是因为 与
与 或
或 形成配合物,设计实验证明棕绿色是
形成配合物,设计实验证明棕绿色是 的颜色,实验操作是
的颜色,实验操作是_____________ 。
(5)从化学反应速率和限度角度简述对 与
与 溶液反应的认识
溶液反应的认识_____________ 。
 与
与 溶液的反应。取
溶液的反应。取 铜粉加入
铜粉加入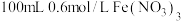 溶液(用
溶液(用 调
调 )中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。已知:
 是难溶于水的白色固体
是难溶于水的白色固体(1)预测铜粉可能发生的反应
反应I
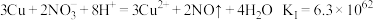
反应II
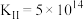
(2)探究反应I是否发生
①取
 铜粉加入
铜粉加入
②用传感器检测
 与
与 溶液反应过程中
溶液反应过程中 浓度的变化,发现
浓度的变化,发现 浓度逐渐减少。有同学认为:
浓度逐渐减少。有同学认为: 催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。ⅰ.
ⅱ.反应II
总反应:
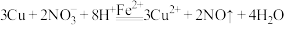
(3)探究反应II是否发生
取
 铜粉加入
铜粉加入 溶液,出现白色浑浊且溶液变红,振荡后红色褪去,
溶液,出现白色浑浊且溶液变红,振荡后红色褪去, 溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因
溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因(4)分析“溶液呈棕绿色,未见有气泡产生”的原因
小组讨论认为,棕绿色可能是因为
 与
与 或
或 形成配合物,设计实验证明棕绿色是
形成配合物,设计实验证明棕绿色是 的颜色,实验操作是
的颜色,实验操作是(5)从化学反应速率和限度角度简述对
 与
与 溶液反应的认识
溶液反应的认识
您最近一年使用:0次
名校
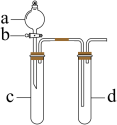
9 . 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。______ 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸。c中的现象是:______ 。再由a向c中加2mL蒸馏水,c中的实验现象是:______ ,离子反应方程式是:______ 。
(3)用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应
②铜与浓硝酸反应
③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应
以下叙述不正确 的是_____ (填字母)。
A.三种途径所消耗铜的质量相等
B.三种途径所消耗硝酸的物质的量①>②>③
C.途径①中被氧化的铜与被还原的硝酸的物质的量之比是3∶2
(4)表格是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是:______ 。理由是:_____ 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸。c中的现象是:
(3)用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应
②铜与浓硝酸反应
③铜先与氧气反应生成氧化铜,氧化铜再跟硝酸反应
以下叙述
A.三种途径所消耗铜的质量相等
B.三种途径所消耗硝酸的物质的量①>②>③
C.途径①中被氧化的铜与被还原的硝酸的物质的量之比是3∶2
(4)表格是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是:
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
您最近一年使用:0次
2023-01-04更新
|
407次组卷
|
2卷引用:北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷
名校
解题方法
10 . 下列反应的离子方程式书写正确的是
A.碳酸钙与稀盐酸反应:CO +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| B.氯气与NaOH反应:Cl2+2NaOH=2Na++Cl-+ClO-+H2O |
| C.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓ |
D.铜与稀硝酸反应:Cu+4H++2NO =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
您最近一年使用:0次



