名校
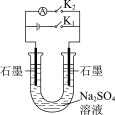
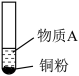
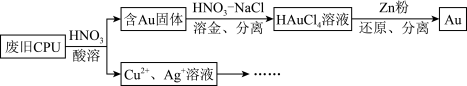
1 . 用如图方法回收废旧CPU中的单质 (金)、
(金)、 和
和 。
。 溶解。②
溶解。② :
:
(1)浓、稀 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:________ 。
(2) 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
①将溶金反应的化学方程式补充完整:_____ 
②关于溶金的下列说法正确的是_____ 。
A.用到了 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与 也可使
也可使 溶解
溶解
(3)若用 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为_____  。
。
(4)用适当浓度的盐酸、 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。_____ ,试剂2是_________ 。
 (金)、
(金)、 和
和 。
。
 溶解。②
溶解。② :
:(1)浓、稀
 均可作酸溶试剂,溶解等量的
均可作酸溶试剂,溶解等量的 消耗
消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(2)
 与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。
与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同。①将溶金反应的化学方程式补充完整:

②关于溶金的下列说法正确的是
A.用到了
 的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性
的氧化性B.王水中浓盐酸的主要作用是增强溶液的酸性C.用浓盐酸与
 也可使
也可使 溶解
溶解(3)若用
 粉将溶液中的
粉将溶液中的 完全还原,则参加反应的
完全还原,则参加反应的 的物质的量为
的物质的量为 。
。(4)用适当浓度的盐酸、
 溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收
溶液、氨水与铁粉,可按照如图方法从酸溶后的溶液中回收 和
和 (图中标注的试剂和物质均不同)。
(图中标注的试剂和物质均不同)。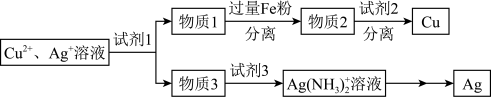
您最近一年使用:0次
名校
2 . 下列实验能达到实验目的的是
| A | B |
|
|
| 制作简单的燃料电池 | 证明苯环使羟基活化 |
| C | D |
|
|
制备并收集 | 检验溴乙烷的水解产物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-23更新
|
125次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三上学期期中考试化学试题
名校
3 . 下列叙述不正确 的是
| A.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量固体CuSO4,加快速率 |
| B.在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉溶解 |
| C.向FeCl3溶液中滴加氨水,产生红褐色沉淀;再加入NaHSO4溶液,沉淀消失 |
| D.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
您最近一年使用:0次
2023-10-15更新
|
193次组卷
|
2卷引用:北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题
解题方法
4 . 某小组同学探究铜和浓硝酸的反应,进行如下实验:
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
(1)写出铜和浓硝酸反应的离子反应方程式:______ 。
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:______ 。
(3)取⑤中溶液,______ (填操作和现象),证实猜想2成立。
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
结合上述实验现象,下列推测合理的是______ (填字母序号)。
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O HNO3+HNO2(慢)
HNO3+HNO2(慢)
反应2:2HNO2 NO2+NO+H2O(快)
NO2+NO+H2O(快)
解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因______ 。
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
①实验中加入的固体物质可能是______ (写出一种,填化学式)。
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,______ ,______ 。
实验1:分别取3mL浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如表:
| 编号 | ① | ② | ③ | ④ | ⑤ |
| 铜粉质量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
| 溶液颜色 | 绿色 | 草绿色 | 蓝绿色偏绿 | 蓝绿色偏蓝 | 蓝色 |
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜浓度较高,溶液呈绿色;
猜想2:NO2溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1不合理,理由是:
(3)取⑤中溶液,
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
| 通入气体 | 氮气 | 空气 |
| 现象 | 液面上方出现明显的红棕色气体,25min后溶液变为蓝色 | 液面上方出现明显的红棕色气体,5min后溶液变为蓝色 |
a.①中溶液通入N2时,N2被缓慢氧化为NO2
b.①中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化
c.空气中的CO2溶于水显酸性,促进了溶液变蓝色
d.加热溶液①后,可能观察到溶液变蓝的现象
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸(HNO2)”可能是实验①中溶液显绿色的主要原因
ii.NO2在溶液中存在:
反应1:2NO2+H2O
 HNO3+HNO2(慢)
HNO3+HNO2(慢)反应2:2HNO2
 NO2+NO+H2O(快)
NO2+NO+H2O(快)解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因
(6)小组同学为确认亚硝酸(HNO2)参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
| 加入物质 | ______固体 | 3滴30%H2O2溶液 | 3滴水 |
| 现象 | 溶液绿色变深 | 溶液迅速变为蓝色 | 溶液颜色几乎不变 |
②加入H2O2后溶液迅速变蓝,原因是的H2O2可能参与了下列反应(用化学方程式表示):H2O2+2NO2=2HNO3,
您最近一年使用:0次
名校
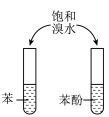
5 . 小组同学探究 和物质A的反应,实验如下。
和物质A的反应,实验如下。
下列分析不正确 的是
 和物质A的反应,实验如下。
和物质A的反应,实验如下。| 装置 | 序号 | 物质A | 实验现象 |
| ① | 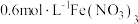 溶液(调 溶液(调 ) ) | 铜粉溶解,溶液变为深棕色[经检验含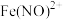 ] ] |
| ② | 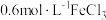 溶液 溶液 | 铜粉溶解,溶液变为蓝绿色 | |
| ③ | 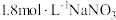 溶液(调 溶液(调 ) ) | 无明显变化 |
A.②中铜粉溶解的原因: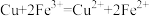 |
B.①中产生 的原因: 的原因: 时直接将 时直接将 还原为 还原为 |
C.若向③中加入 固体,推测铜粉会溶解 固体,推测铜粉会溶解 |
| D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关 |
您最近一年使用:0次
2023-05-07更新
|
1421次组卷
|
15卷引用:北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题
北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题北京师范大学附属实验中学2023-2024学年暑期高三第一次督导化学试题北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市第一○一中学2023-2024学年高三上学期10月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题北京市第二十中学2023-2024学年高三上学期12月月考化学试题北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题北京市第二中学2023-2024学年高三下学期开学考试化学试卷(已下线)第7讲 金属材料和金属矿物利用(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)北京市顺义牛栏山第一中学2023-2024学年高二上学期10月月考化学试题山东省青岛第二中学2023-2024学年高三上学期期中考试化学试卷(已下线)热点19 化学微型实验北京市八一学校2023-2024学年高一下学期3月月考化学试题湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题
名校
6 . 根据如图所示装置进行实验,能得到相应结论的是。
| 试剂a、b | 现象 | 结论 | 装置 | |
| A |  、稀 、稀 | 产生的无色气体在导管口变红棕色 |  和稀 和稀 反应生成 反应生成 |
|
| B | 漂白粉、浓 | 导管口放置的湿润蓝色石蕊试纸先变红后褪色。 | 漂白粉和浓 反应生成 反应生成 | |
| C |  、75%酒精溶液 、75%酒精溶液 | 收集产生的气体,移近火焰,发出爆鸣声 |  和 和 反应生成 反应生成 | |
| D | 电石、饱和食盐水 | 产生的气体使酸性高锰酸钾溶液褪色 |  和 和 反应生成 反应生成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-06更新
|
451次组卷
|
4卷引用:北京市海淀区2022-2023学年高三下学期期中练习化学试题
名校
解题方法
7 . 下列关于铜腐蚀的说法及方程式书写正确的是
A.铜在潮湿空气中被腐蚀: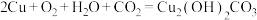 |
B.铜在 环境中被腐蚀: 环境中被腐蚀: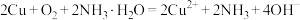 |
C. 浓度越大,腐蚀反应 浓度越大,腐蚀反应 速率越大 速率越大 |
D.利用 对铜的腐蚀制作印刷线路板: 对铜的腐蚀制作印刷线路板: |
您最近一年使用:0次
2023-03-30更新
|
625次组卷
|
4卷引用:北京市朝阳区2023届高三一模考试化学试题
名校
解题方法
8 . 对于1 L  和
和 的混合溶液,若
的混合溶液,若 和
和 物质的量浓度存在如下关系:
物质的量浓度存在如下关系: ,理论上最多能溶解铜的物质的量为
,理论上最多能溶解铜的物质的量为
 和
和 的混合溶液,若
的混合溶液,若 和
和 物质的量浓度存在如下关系:
物质的量浓度存在如下关系: ,理论上最多能溶解铜的物质的量为
,理论上最多能溶解铜的物质的量为| A.0.9 mol | B.0.8 mol | C.0.45 mol | D.0.40 mol |
您最近一年使用:0次
解题方法
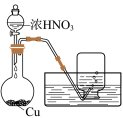
9 . 某化学小组探究铜和稀硝酸的反应:
资料1 铜与浓度低于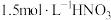 反应很慢,且放热极少。
反应很慢,且放热极少。
(1)实验预测
①铜与稀 反应的离子方程式为
反应的离子方程式为_______ 。
②小组同学预测铜与稀 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是_______ 。
(2)实验实施
实验I:铜丝与 反应。
反应。
实验II:探究Cu与稀 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:
资料2:
i.上述溶液中均不存在-3价的氮; 为淡黄色沉淀。
为淡黄色沉淀。
ii. 是一种弱酸,
是一种弱酸, ;
;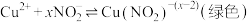
①通过上述实验,证明铜与稀 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是_______ 。
②分析阶段B溶液呈绿色的原因_______ 。
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因_______ 。
④写出铜和稀 反应的生成
反应的生成 的化学方程式
的化学方程式_______ 。
(3)继续探究:
探究铜和稀 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
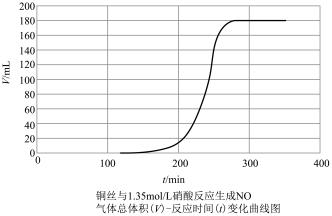
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为_______ 。
(4)反思总结:通过上述实验探究过程,铜和 的反应实际过程可能为
的反应实际过程可能为_______ 。
资料1 铜与浓度低于
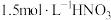 反应很慢,且放热极少。
反应很慢,且放热极少。(1)实验预测
①铜与稀
 反应的离子方程式为
反应的离子方程式为②小组同学预测铜与稀
 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是(2)实验实施
实验I:铜丝与
 反应。
反应。| 实验装置 | 实验操作 | 实验现象 |
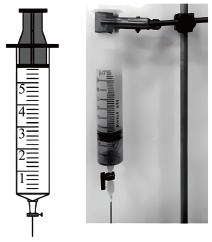 | 在洁净的注射器中装入已活化铜丝2.3g,再用注射器抽取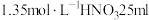 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 反应体系处于无氧环境中。 反应体系处于无氧环境中。 | 反应较慢阶段A:反应前90min几乎没有现象,90min左右才有很少气泡产生(该气体遇空气变成红棕色),溶液为浅蓝色;反应较快阶段B:之后溶液逐渐变为绿色;最后阶段C:在反应结束前15min左右时,体系溶液为深蓝色。 |
 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:操作及现象 实验序号 | 取不同阶段的溶液进行实验操作 | 实验现象 | ||
| 阶段A溶液 | 阶段B溶液 | 阶段C溶液 | ||
| 1 | 滴加 酸性 酸性 溶液 溶液 | 褪色,滴6滴后溶液不褪色 | 褪色,但滴20滴后溶液仍然褪色 | 褪色,滴10滴后溶液不再褪色 |
| 2 | 滴加3% 溶液 溶液 | 无明显现象 | 少量淡黄色沉淀 | 较多黄色沉淀 |
| 3 | 滴加稀 溶液 溶液 | 无明显现象 | 变蓝色 | 无明显现象 |
i.上述溶液中均不存在-3价的氮;
 为淡黄色沉淀。
为淡黄色沉淀。ii.
 是一种弱酸,
是一种弱酸, ;
;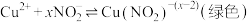
①通过上述实验,证明铜与稀
 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是②分析阶段B溶液呈绿色的原因
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因
④写出铜和稀
 反应的生成
反应的生成 的化学方程式
的化学方程式(3)继续探究:
探究铜和稀
 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物
 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为(4)反思总结:通过上述实验探究过程,铜和
 的反应实际过程可能为
的反应实际过程可能为
您最近一年使用:0次
2023-01-09更新
|
763次组卷
|
4卷引用:北京市顺义区2023届高三第一次统练化学试题
解题方法
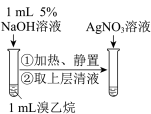
10 . 解释下列事实所用的化学用语不正确 的是
A.酚酞滴入 溶液中,溶液变红: 溶液中,溶液变红: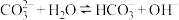 |
B.铜片放入浓硝酸中,产生红棕色气体: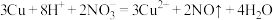 |
C.钢铁发生吸氧腐蚀,负极反应: |
D. 通入溴水中,溶液褪色: 通入溴水中,溶液褪色: |
您最近一年使用:0次