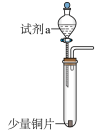
1 . 用下图装置探究铜与硝酸的反应,实验记录如下:
下列说法不正确的是

| 步骤 | 操作 | 现象 |
| ① | 打开止水夹,挤压胶头,使浓硝酸滴入试管 | 产生红棕色气体,溶液变为绿色 |
| ② | 一段时间后,关闭止水夹,推动注射器活塞使部分水进入试管 | 注射器内剩余的水被“吸入”试管;铜表面产生无色气泡,溶液变蓝,试管内气体逐渐变为无色 |
| ③ | 一段时间后, 打开止水夹,拉动注射器活塞吸取少量无色气体;拔下注射器,再拉动活塞吸入少量空气 | 注射器中无色气体变红棕色 |
| A.①中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑ + 2H2O |
| B.②中注射器内剩余的水被“吸入”试管的原因可能是NO2与H2O反应导致压强减小 |
| C.②中铜表面产生的气体可能有H2 |
| D.③中的实验现象能证明②中反应生成了NO |
您最近一年使用:0次
2022-01-12更新
|
177次组卷
|
2卷引用:北京市昌平区2021-2022学年高一上学期期末考试化学试题
名校
解题方法
2 . 同学们探究不同金属和浓硫酸的反应。向三等份浓硫酸中分别加入大小相同的不同金属片,加热,用生成气体进行下表实验操作并记录实验现象。
已知: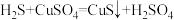 (CuS为黑色固体);
(CuS为黑色固体); 可燃
可燃
下列说法不正确 的是
| 实验操作 | 实验现象 | ||
| 金属为铜 | 金属为锌 | 金属为铝 | |
| 点燃 | 不燃烧 | 燃烧 | 燃烧 |
通入 酸性溶液 酸性溶液 | 褪色 | 褪色 | 褪色 |
通入 溶液 溶液 | 无明显变化 | 无明显变化 | 出现黑色沉淀 |
| 通入品红溶液 | 褪色 | 褪色 | 不褪色 |
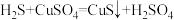 (CuS为黑色固体);
(CuS为黑色固体); 可燃
可燃下列说法
A.加入铜片的实验中,使 酸性溶液褪色的气体是 酸性溶液褪色的气体是 |
B.加入铝片的实验中,燃烧现象能证明生成气体中一定含 |
| C.加入锌片的实验中,生成的气体一定是混合气体 |
| D.金属与浓硫酸反应的还原产物与金属活动性强弱有关 |
您最近一年使用:0次
2021-05-10更新
|
1528次组卷
|
16卷引用:北京市海淀区2021届高三二模化学试题
北京市海淀区2021届高三二模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(02)北京首都师范大学附属中学2021-2022学年高三上学期10月月考化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京市房山区2022-2023学年高三二模化学试题北京市中国人民大学附属中学2023-2024学年高三下学期一模模拟化学试题北京市第八十中学2023-2024学年高一下学期期中考试化学(选考)试题(已下线)第13讲 硫及其化合物(精练)-2022年高考化学一轮复习讲练测(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练辽宁省沈阳市东北育才学校2021-2022学年高三上学期学段考试化学试题趋势4 创新探究类实验(已下线)第四章 非金属及其化合物 第21练 硫酸 含硫物质的转化广东省广州市番禺中学2022-2023学年高一下学期4月期中考试化学试题云南省昆明市第一中学2022-2023学年高一下学期期中考试化学试题(已下线)第4讲 浓硫酸 不同价态含硫物质的转化
名校
解题方法
3 . 研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ产生红棕色气体的离子方程式是___________ 。实验Ⅱ产生红棕色气体的化学方程式是___________ 。
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色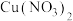 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是___________ ,滴加少量蓝色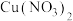 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
| 装置 | 编号 | 试剂a | 现象 |
| Ⅰ | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体。 |
| Ⅱ | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色。 |
(1)实验Ⅰ产生红棕色气体的离子方程式是
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色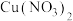 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是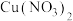 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

 的证据是
的证据是Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
名校
4 . 下列实验能达到实验目的的是
| A | B |
|
|
| 制作简单的燃料电池 | 证明苯环使羟基活化 |
| C | D |
|
|
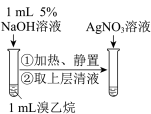
制备并收集 | 检验溴乙烷的水解产物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-23更新
|
125次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三上学期期中考试化学试题
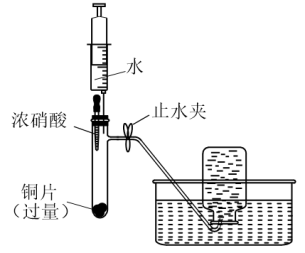
5 . 某小组同学利用下面的实验装置(气密性已检验,试管内预先充满氮气)验证硝酸的性质。
试填空:
(1)步骤i中,红棕色气体是___________ 。
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是___________ 。
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为___________ 。
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由___________ 。
| 实验装置 | 实验步骤 | 实验现象 |
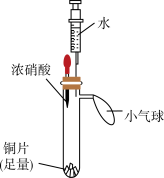 | i.挤压胶头,使浓硝酸滴入试管 | 产生红棕色气体,溶液变为绿色 |
| ii.一段时间后,推动注射器活塞,使水全部进入试管 | 铜片表面产生气泡,溶液变蓝,试管内气体逐渐变为无色 | |
| iii. 试管内气体变为无色后,拉动注射器活塞,吸取少量无色气体;拔下注射器,再拉动活塞吸入少量空气 | 注射器中无色气体变为红棕色 |
(1)步骤i中,红棕色气体是
(2)步骤ii中,浓硝酸被稀释成稀硝酸,能说明稀硝酸具有氧化性的现象是
(3)步骤iii中,注射器中无色气体变为红棕色,发生反应的化学方程式为
(4)上述实验能否证明铜与稀硝酸反应生成NO,并说明理由
您最近一年使用:0次
6 . 某研究小组对甲醛的性质进行推测和验证。
Ⅰ.性质推测:
同学甲认为,甲醛的性质应该与乙醛类似,在加热的条件下甲醛可以与新制Cu(OH)2悬浊液反应,且产物是Cu2O和甲酸钠。
(1)写出同学甲所预期的该反应的化学方程式___________ 。
Ⅱ.实验验证:
向3.5 mL新制氢氧化铜碱性悬浊液中加40%福尔马林溶液2mL,加热,有较多无色气
泡逸出。最终试管内所得红色沉淀与乙醛跟氢氧化铜悬浊液反应所得的固体颜色有所不同,试管内壁沉积了一层紫红色的固体物质。
同学甲分别对实验过程中产生的红色沉淀及气体的成分进行探究。
(2)取少量实验中所得的红色沉淀于试管中,加入适量浓氨水,振荡,溶液颜色无明显变化,静置数小时后,溶液颜色略呈浅蓝色,但试管底部红色沉淀的量变化不大。由此判断红色沉淀可能是___________ (写化学式)。用离子方程式解释溶液略呈浅蓝色的原因___________ 。
(3)为进一步验证上述结论,另取少量实验中所得的红色沉淀于试管,加入___________ 。
a.稀硫酸 b.稀硝酸 c.浓硝酸
若观察到___________ 的现象,可证明前面判断正确。
(4)同学甲认为无色气体可能是二氧化碳、甲醛或两者的混合气体。同学乙认为该气体中不可能含有二氧化碳,理由是___________ ,乙同学将产生的无色气体通入银氨溶液,水浴加热,试管壁上很快就有银镜形成。
同学们据此实验现象判断:无色气体的成分是甲醛。
(5)甲乙两同学进一步查阅资料,发现无色气体的主要成分也可能是CO。设计如下实验方案,进一步探究:

实验现象:氧化铜由黑变红、澄清石灰水变浑浊。
方案中水洗的目的是___________ 。
Ⅰ.性质推测:
同学甲认为,甲醛的性质应该与乙醛类似,在加热的条件下甲醛可以与新制Cu(OH)2悬浊液反应,且产物是Cu2O和甲酸钠。
(1)写出同学甲所预期的该反应的化学方程式
Ⅱ.实验验证:
向3.5 mL新制氢氧化铜碱性悬浊液中加40%福尔马林溶液2mL,加热,有较多无色气
泡逸出。最终试管内所得红色沉淀与乙醛跟氢氧化铜悬浊液反应所得的固体颜色有所不同,试管内壁沉积了一层紫红色的固体物质。
| 【资料】 ① 甲醛属于强还原剂,在碱性条件下还原性更强,在空气中能缓慢氧化成甲酸。 ② CO也能还原银氨溶液产生银镜。 ③ Cu2O在酸性溶液中能转化为Cu2+、Cu。 ④ Cu2O能溶于浓氨水形成无色配合物离子[Cu(NH3)2]+,并在空气中立即被氧化为蓝色的[Cu(NH3)4]2+。置于空气中,Cu也能缓慢溶于浓氨水生成蓝色的[Cu(NH3)4]2+。 |
(2)取少量实验中所得的红色沉淀于试管中,加入适量浓氨水,振荡,溶液颜色无明显变化,静置数小时后,溶液颜色略呈浅蓝色,但试管底部红色沉淀的量变化不大。由此判断红色沉淀可能是
(3)为进一步验证上述结论,另取少量实验中所得的红色沉淀于试管,加入
a.稀硫酸 b.稀硝酸 c.浓硝酸
若观察到
(4)同学甲认为无色气体可能是二氧化碳、甲醛或两者的混合气体。同学乙认为该气体中不可能含有二氧化碳,理由是
同学们据此实验现象判断:无色气体的成分是甲醛。
(5)甲乙两同学进一步查阅资料,发现无色气体的主要成分也可能是CO。设计如下实验方案,进一步探究:

实验现象:氧化铜由黑变红、澄清石灰水变浑浊。
方案中水洗的目的是
您最近一年使用:0次
名校
解题方法
7 . 某化学小组研究硝酸与金属的反应。下列实验中硝酸与金属的反应均在注射器中完成,实验操作及实验现象记录如表:
(1)铜与浓HNO3反应产生红棕色气体的化学方程式是___________ 。
(2)对实验1所得溶液呈绿色,而实验2所得溶液呈蓝色的原因提出猜想。
查阅资料:i.NO2溶于稀硝酸会反应;而溶于浓硝酸不反应,使溶液呈黄色;
ii.NO2与水反应时会有部分发生反应:2NO2 + H2O = HNO3 + HNO2,HNO2是弱酸,不稳定。
猜想一:NO2溶于浓硝酸,与蓝色Cu(NO3)2溶液混合而呈现绿色。
猜想二:HNO2电离出的NO 与Cu2+结合为Cu(NO2)
与Cu2+结合为Cu(NO2) (绿色)。
(绿色)。
① 向浓硝酸中通入NO2,溶液呈黄色,加入___________ (填试剂)后呈绿色,证实猜想一合理。
② 研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。
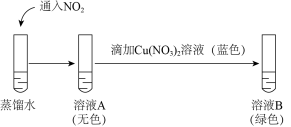
a.证明溶液A中含有HNO2的证据是___________ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是 实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
(3)实验2中充入O2后气体变为红棕色的反应的化学方程式是___________ 。
(4)查阅文献:铁粉与稀硝酸反应会生成H2。由实验3中的实验现象可知,过量的铁粉与0.5 mol/L稀HNO3反应的还原产物中除了H2外,还有___________ 生成。写出白色沉淀,迅速变为灰绿色,最后变成红褐色的化学方程式___________ 。
(5)甲同学对实验3产生H2的原因提出假设:该浓度的硝酸中 H+ 的氧化性大于NO 。乙同学认为该假设不合理。依据是实验2中观察到了
。乙同学认为该假设不合理。依据是实验2中观察到了___________ (填实验现象),该现象能说明假设不合理,理由是___________ 。
(6)结合以上实验可知,金属与硝酸反应的产物与___________ 等因素有关。
| 序号 | 实验操作与实验现象 |
| 实验1 | 加入过量的铜片与2mL的浓硝酸。反应剧烈,产生红棕色气体,溶液立即呈绿色。 |
| 实验2 | 加入过量的铜片与2 mL 0.5 mol/L HNO3溶液。产生无色气泡,溶液逐渐变为蓝色。注射器中的气体始终无色。反应结束后,向注射器中充入一定量的O2,气体迅速变为红棕色 |
| 实验3 | 加入过量的铁粉与2 mL 0.5 mol/L HNO3溶液,立即有无色气体生成,溶液为很浅的绿色,反应结束后将气体通入有空气的容器无明显变化,点燃,有尖锐的爆鸣声,容器壁出现无色液滴;取反应后溶液,加入足量NaOH溶液,立刻得到白色沉淀,迅速变为灰绿色,最后变成红褐色,加热后产生能使湿润红色石蕊试纸变蓝的气体。 |
(2)对实验1所得溶液呈绿色,而实验2所得溶液呈蓝色的原因提出猜想。
查阅资料:i.NO2溶于稀硝酸会反应;而溶于浓硝酸不反应,使溶液呈黄色;
ii.NO2与水反应时会有部分发生反应:2NO2 + H2O = HNO3 + HNO2,HNO2是弱酸,不稳定。
猜想一:NO2溶于浓硝酸,与蓝色Cu(NO3)2溶液混合而呈现绿色。
猜想二:HNO2电离出的NO
 与Cu2+结合为Cu(NO2)
与Cu2+结合为Cu(NO2) (绿色)。
(绿色)。① 向浓硝酸中通入NO2,溶液呈黄色,加入
② 研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

a.证明溶液A中含有HNO2的证据是
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二
(3)实验2中充入O2后气体变为红棕色的反应的化学方程式是
(4)查阅文献:铁粉与稀硝酸反应会生成H2。由实验3中的实验现象可知,过量的铁粉与0.5 mol/L稀HNO3反应的还原产物中除了H2外,还有
(5)甲同学对实验3产生H2的原因提出假设:该浓度的硝酸中 H+ 的氧化性大于NO
 。乙同学认为该假设不合理。依据是实验2中观察到了
。乙同学认为该假设不合理。依据是实验2中观察到了(6)结合以上实验可知,金属与硝酸反应的产物与
您最近一年使用:0次
解题方法
8 . 某化学小组探究铜和稀硝酸的反应:
资料1 铜与浓度低于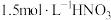 反应很慢,且放热极少。
反应很慢,且放热极少。
(1)实验预测
①铜与稀 反应的离子方程式为
反应的离子方程式为_______ 。
②小组同学预测铜与稀 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是_______ 。
(2)实验实施
实验I:铜丝与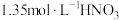 反应。
反应。
实验II:探究Cu与稀 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:
资料2:
i.上述溶液中均不存在-3价的氮;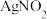 为淡黄色沉淀。
为淡黄色沉淀。
ii. 是一种弱酸,
是一种弱酸, ;
;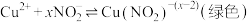
①通过上述实验,证明铜与稀 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是_______ 。
②分析阶段B溶液呈绿色的原因_______ 。
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因_______ 。
④写出铜和稀 反应的生成
反应的生成 的化学方程式
的化学方程式_______ 。
(3)继续探究:
探究铜和稀 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
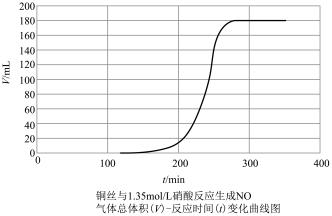
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为_______ 。
(4)反思总结:通过上述实验探究过程,铜和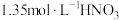 的反应实际过程可能为
的反应实际过程可能为_______ 。
资料1 铜与浓度低于
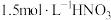 反应很慢,且放热极少。
反应很慢,且放热极少。(1)实验预测
①铜与稀
 反应的离子方程式为
反应的离子方程式为②小组同学预测铜与稀
 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是(2)实验实施
实验I:铜丝与
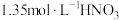 反应。
反应。| 实验装置 | 实验操作 | 实验现象 |
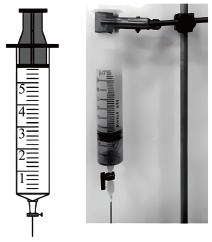 | 在洁净的注射器中装入已活化铜丝2.3g,再用注射器抽取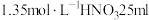 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 ,同时排尽注射器中的空气,关闭注射器止水开关,以保证铜丝与稀 反应体系处于无氧环境中。 反应体系处于无氧环境中。 | 反应较慢阶段A:反应前90min几乎没有现象,90min左右才有很少气泡产生(该气体遇空气变成红棕色),溶液为浅蓝色;反应较快阶段B:之后溶液逐渐变为绿色;最后阶段C:在反应结束前15min左右时,体系溶液为深蓝色。 |
 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:操作及现象 实验序号 | 取不同阶段的溶液进行实验操作 | 实验现象 | ||
| 阶段A溶液 | 阶段B溶液 | 阶段C溶液 | ||
| 1 | 滴加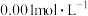 酸性 酸性 溶液 溶液 | 褪色,滴6滴后溶液不褪色 | 褪色,但滴20滴后溶液仍然褪色 | 褪色,滴10滴后溶液不再褪色 |
| 2 | 滴加3% 溶液 溶液 | 无明显现象 | 少量淡黄色沉淀 | 较多黄色沉淀 |
| 3 | 滴加稀 溶液 溶液 | 无明显现象 | 变蓝色 | 无明显现象 |
i.上述溶液中均不存在-3价的氮;
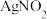 为淡黄色沉淀。
为淡黄色沉淀。ii.
 是一种弱酸,
是一种弱酸, ;
;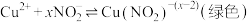
①通过上述实验,证明铜与稀
 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是②分析阶段B溶液呈绿色的原因
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因
④写出铜和稀
 反应的生成
反应的生成 的化学方程式
的化学方程式(3)继续探究:
探究铜和稀
 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物
 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为(4)反思总结:通过上述实验探究过程,铜和
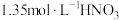 的反应实际过程可能为
的反应实际过程可能为
您最近一年使用:0次
2023-01-09更新
|
763次组卷
|
4卷引用:北京市顺义区2023届高三第一次统练化学试题
解题方法
9 . 某实验小组探究 与
与 溶液的反应。取
溶液的反应。取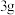 铜粉加入
铜粉加入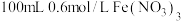 溶液(用
溶液(用 调
调 )中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
已知: 是难溶于水的白色固体
是难溶于水的白色固体
(1)预测铜粉可能发生的反应
反应I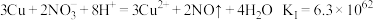
反应II__________________________ 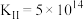
(2)探究反应I是否发生
①取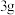 铜粉加入
铜粉加入
_____________ 溶液中,振荡、静置30分钟,无明显现象。(所用试剂:硝酸钠和硝酸溶液)
②用传感器检测 与
与 溶液反应过程中
溶液反应过程中 浓度的变化,发现
浓度的变化,发现 浓度逐渐减少。有同学认为:
浓度逐渐减少。有同学认为: 催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
ⅰ._____________
ⅱ.反应II
总反应: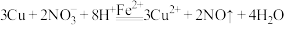
(3)探究反应II是否发生
取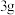 铜粉加入
铜粉加入_____________ 中,溶液迅速变为蓝绿色。取上层清液,滴加 溶液,出现白色浑浊且溶液变红,振荡后红色褪去,
溶液,出现白色浑浊且溶液变红,振荡后红色褪去, 溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因
溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因_____________ 。
(4)分析“溶液呈棕绿色,未见有气泡产生”的原因
小组讨论认为,棕绿色可能是因为 与
与 或
或 形成配合物,设计实验证明棕绿色是
形成配合物,设计实验证明棕绿色是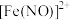 的颜色,实验操作是
的颜色,实验操作是_____________ 。
(5)从化学反应速率和限度角度简述对 与
与 溶液反应的认识
溶液反应的认识_____________ 。
 与
与 溶液的反应。取
溶液的反应。取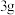 铜粉加入
铜粉加入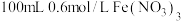 溶液(用
溶液(用 调
调 )中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。已知:
 是难溶于水的白色固体
是难溶于水的白色固体(1)预测铜粉可能发生的反应
反应I
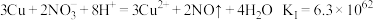
反应II
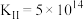
(2)探究反应I是否发生
①取
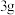 铜粉加入
铜粉加入
②用传感器检测
 与
与 溶液反应过程中
溶液反应过程中 浓度的变化,发现
浓度的变化,发现 浓度逐渐减少。有同学认为:
浓度逐渐减少。有同学认为: 催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。ⅰ.
ⅱ.反应II
总反应:
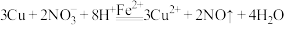
(3)探究反应II是否发生
取
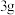 铜粉加入
铜粉加入 溶液,出现白色浑浊且溶液变红,振荡后红色褪去,
溶液,出现白色浑浊且溶液变红,振荡后红色褪去, 溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因
溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因(4)分析“溶液呈棕绿色,未见有气泡产生”的原因
小组讨论认为,棕绿色可能是因为
 与
与 或
或 形成配合物,设计实验证明棕绿色是
形成配合物,设计实验证明棕绿色是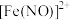 的颜色,实验操作是
的颜色,实验操作是(5)从化学反应速率和限度角度简述对
 与
与 溶液反应的认识
溶液反应的认识
您最近一年使用:0次
名校
解题方法
10 . 为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I 反应产物的定性探究
实验装置如图所示。(固定装置已略去)
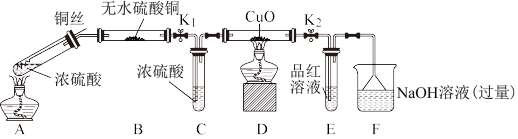
(1)A中反应的化学方程式为_______ 。
(2)无水硫酸铜的作用是:_______ 。
(3)F烧杯中的溶液通常是过量的氢氧化钠溶液,写出其发生反应的离子方程式_______ 。
(4)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_______ 。
(5)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是_______ 。
实验II 反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,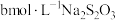 溶液滴定生成的
溶液滴定生成的 ,3次实验平均消耗该
,3次实验平均消耗该 溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为
溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为_______ 。
(已知: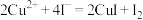 ,
, )
)
实验I 反应产物的定性探究
实验装置如图所示。(固定装置已略去)

(1)A中反应的化学方程式为
(2)无水硫酸铜的作用是:
(3)F烧杯中的溶液通常是过量的氢氧化钠溶液,写出其发生反应的离子方程式
(4)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(5)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
实验II 反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,
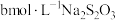 溶液滴定生成的
溶液滴定生成的 ,3次实验平均消耗该
,3次实验平均消耗该 溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为
溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为(已知:
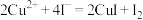 ,
, )
)
您最近一年使用:0次