1 . 下列方程式与所给事实相符的是
A.实验室制氯气时,用氢氧化钠溶液吸收多余的氯气: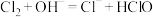 |
B.铜和浓硝酸反应,产生红棕色气体: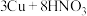 (浓) (浓) |
C.苯酚浊液中滴加碳酸钠溶液后变澄清: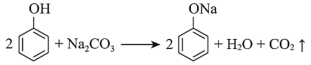 |
D.用热的 溶液去除油污(以硬脂酸甘油酯为例): 溶液去除油污(以硬脂酸甘油酯为例):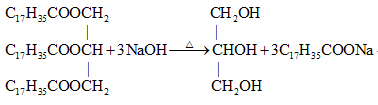 |
您最近一年使用:0次
2 . 用如下方法回收废旧CPU中的单质Au(金)、Ag和Cu。
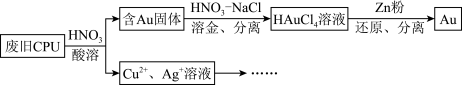
已知:①浓硝酸不能单独将Au溶解。
② 。
。
(1)酸溶后经_______ 操作,将混合物分离。
(2)浓、稀HNO3均可作酸溶试剂,浓硝酸被还原成NO2,稀硝酸被还原成NO。溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量少的反应的化学方程式:_______ 。
(3)HNO3-NaCl与王水[V(浓硝酸):V(浓盐酸)=1∶3]溶金原理相同,Cl-与Au3+形成配离子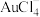 ,促进了金溶解。
,促进了金溶解。
①将溶金反应的化学方程式补充完整:_______ 。
 _______
_______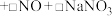
②关于溶金的下列说法正确的是_______ 。
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是_____ mol。
(5)用适当浓度的盐酸、NaCl溶液、氨水与铁粉,可按照如下方法从酸溶后的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。
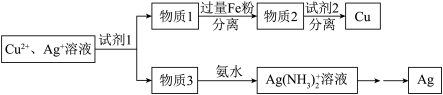
试剂1是_______ ,物质2是_______ ,物质3是_______ 。

已知:①浓硝酸不能单独将Au溶解。
②
 。
。(1)酸溶后经
(2)浓、稀HNO3均可作酸溶试剂,浓硝酸被还原成NO2,稀硝酸被还原成NO。溶解等量的Cu消耗HNO3的物质的量不同,写出消耗HNO3物质的量少的反应的化学方程式:
(3)HNO3-NaCl与王水[V(浓硝酸):V(浓盐酸)=1∶3]溶金原理相同,Cl-与Au3+形成配离子
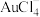 ,促进了金溶解。
,促进了金溶解。①将溶金反应的化学方程式补充完整:
 _______
_______
②关于溶金的下列说法正确的是
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是
(5)用适当浓度的盐酸、NaCl溶液、氨水与铁粉,可按照如下方法从酸溶后的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。

试剂1是
您最近一年使用:0次
名校
3 . 一定温度下,探究铜与稀 反应,过程如图,下列说法
反应,过程如图,下列说法不正确 的是
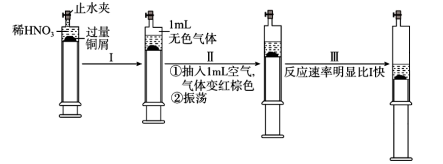
 反应,过程如图,下列说法
反应,过程如图,下列说法
A.过程Ⅰ中生成无色气体的离子方程式 |
B.过程Ⅲ反应速率比Ⅰ快的原因是 溶于水,使 溶于水,使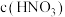 增大 增大 |
C.由实验推测, 对该反应具有催化作用或Ⅰ至Ⅲ过程中溶液温度升高 对该反应具有催化作用或Ⅰ至Ⅲ过程中溶液温度升高 |
| D.当活塞不再移动时,再抽入空气,铜可以继续溶解 |
您最近一年使用:0次
2022-08-02更新
|
450次组卷
|
2卷引用:北京首都师范大学附属中学2021-2022学年高一下学期期末考试化学试题
名校
解题方法
4 . 实验小组研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ、Ⅱ中的红棕色气体均是 。
。
①实验Ⅰ产生 的化学方程式是
的化学方程式是_______ 。
②实验Ⅱ产生 的化学方程式是
的化学方程式是_______ 。
(2)对实验Ⅰ产生 ,实验Ⅱ产生
,实验Ⅱ产生 的原因提出解释。
的原因提出解释。
①硝酸浓度越稀,溶液中单位体积内的 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越_______ (填“大”或“小”),因此越易被还原为较低价态的含氮物质。
②浓硝酸具有较强的_______ 性,可将 转化为
转化为 。
。
(3)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:ⅰ. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ⅱ.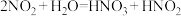 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是_______ ,滴加少量蓝色 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

a.能说明溶液A中含有 的现象是
的现象是_______ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:_______ 。
| 装置 | 编号 | 试剂a | 现象 |
 | Ⅰ | 4 浓硝酸 (过量) 浓硝酸 (过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体 |
| Ⅱ | 4 稀硝酸 (过量) 稀硝酸 (过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色 |
 。
。①实验Ⅰ产生
 的化学方程式是
的化学方程式是②实验Ⅱ产生
 的化学方程式是
的化学方程式是(2)对实验Ⅰ产生
 ,实验Ⅱ产生
,实验Ⅱ产生 的原因提出解释。
的原因提出解释。①硝酸浓度越稀,溶液中单位体积内的
 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越②浓硝酸具有较强的
 转化为
转化为 。
。(3)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:ⅰ.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ⅱ.
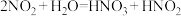 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

a.能说明溶液A中含有
 的现象是
的现象是b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
2022-07-10更新
|
686次组卷
|
2卷引用:北京朝阳区2021-2022学年高一下学期期末考试化学试题
名校
解题方法
5 . 下列反应的离子方程式正确的是
A.铁与稀硫酸反应: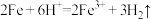 |
B.铜与稀硝酸反应: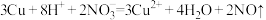 |
C.氢氧化钡与稀硫酸反应: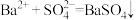 |
D.钠与水反应: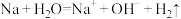 |
您最近一年使用:0次
2022-06-13更新
|
305次组卷
|
3卷引用:北京市朝阳区2021-2022学年高一年级下学期合格考模拟检测化学试题
名校
解题方法
6 . 下列方程式与所给事实不相符 的是
A.浓硝酸用棕色瓶保存: |
B.过量碳酸氢钠与氢氧化钡溶液反应: |
C.铜与稀硝酸反应: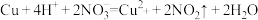 |
D.氢氧化亚铁放置于空气中: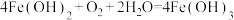 |
您最近一年使用:0次
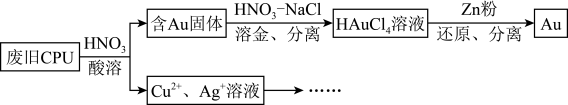
7 . 用如图方法回收废旧CPU中的单质Au(金),Ag和Cu。
(1)酸溶后经_______ 操作,将混合物分离。
(2)浓、稀 均可作酸溶试剂。溶解等量的Cu消耗
均可作酸溶试剂。溶解等量的Cu消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:_______ 。
(3)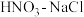 与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
①将溶金反应的化学方程式补充完整:_________________ 。

②关于溶金的下列说法正确的是_______ 。
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是____ mol。

(1)酸溶后经
(2)浓、稀
 均可作酸溶试剂。溶解等量的Cu消耗
均可作酸溶试剂。溶解等量的Cu消耗 的物质的量不同,写出消耗
的物质的量不同,写出消耗 物质的量少的反应的化学方程式:
物质的量少的反应的化学方程式:(3)
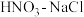 与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。①将溶金反应的化学方程式补充完整:

②关于溶金的下列说法正确的是
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应的Zn的物质的量是
您最近一年使用:0次
2022-05-27更新
|
339次组卷
|
3卷引用:北京市第一六一中学2021-2022学年高一下学期期中阶段(选考班)化学试题
名校
解题方法
8 . 为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I 反应产物的定性探究
实验装置如图所示。(固定装置已略去)
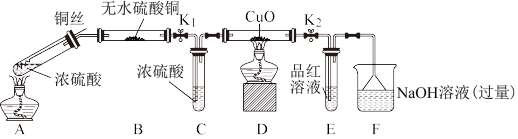
(1)A中反应的化学方程式为_______ 。
(2)无水硫酸铜的作用是:_______ 。
(3)F烧杯中的溶液通常是过量的氢氧化钠溶液,写出其发生反应的离子方程式_______ 。
(4)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_______ 。
(5)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是_______ 。
实验II 反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,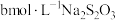 溶液滴定生成的
溶液滴定生成的 ,3次实验平均消耗该
,3次实验平均消耗该 溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为
溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为_______ 。
(已知: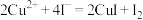 ,
, )
)
实验I 反应产物的定性探究
实验装置如图所示。(固定装置已略去)

(1)A中反应的化学方程式为
(2)无水硫酸铜的作用是:
(3)F烧杯中的溶液通常是过量的氢氧化钠溶液,写出其发生反应的离子方程式
(4)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(5)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
实验II 反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,
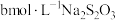 溶液滴定生成的
溶液滴定生成的 ,3次实验平均消耗该
,3次实验平均消耗该 溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为
溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为(已知:
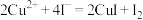 ,
, )
)
您最近一年使用:0次
名校
解题方法
9 . 能用如下装置制取的气体是(夹持仪器略)
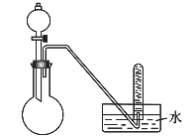
| A.MnO2、浓盐酸反应制取Cl2 | B.Cu、稀硝酸反应制取NO |
| C.Na2SO3、浓硫酸反应制取SO2 | D.Cu、浓硝酸反应制取NO2 |
您最近一年使用:0次
2022-05-26更新
|
98次组卷
|
2卷引用:北京市第二十七中学2021-2022学年高一下学期期中考试化学试题
解题方法
10 . 下列离子方程式书写正确的是
| A.铁片投入稀盐酸中:2Fe+6H+=2Fe3++3H2↑ |
B.稀硝酸与铜片反应:Cu+4H++2NO =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
| C.氯气通入氯化亚铁溶液中:Cl2+Fe2+=2Cl-+Fe3+ |
D.氯化钡溶液滴入硫酸钠溶液中:Ba2++SO =BaSO4↓ =BaSO4↓ |
您最近一年使用:0次



