名校
解题方法
1 . Ⅰ.铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=_______
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为_______
②下列条件能判断该反应达到平衡状态的是_______
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:
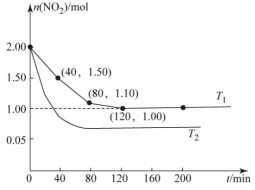
①T1_______ T2(填“>”或“<”)。
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=_______
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_______ 移动(填“正向”“逆向”或“不”)。
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为_______ (室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为
②下列条件能判断该反应达到平衡状态的是
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO
 =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为
您最近一年使用:0次
2021-06-27更新
|
1003次组卷
|
8卷引用:四川省广安市2019-2020学年高二下学期期末(零诊)化学试题
四川省广安市2019-2020学年高二下学期期末(零诊)化学试题(已下线)理综化学-2021年秋季高三开学摸底考试卷01(课标全国专用)2021年海南高考化学试题变式题11-19(已下线)备战2022年高考化学精准检测卷【全国卷】08广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题湖北省天门外国语学校2022-2023学年高二上学期12月月考化学试题四川省内江市威远中学校2022-2023学年高二下学期第二次阶段性考试理综化学试题
2 . 铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
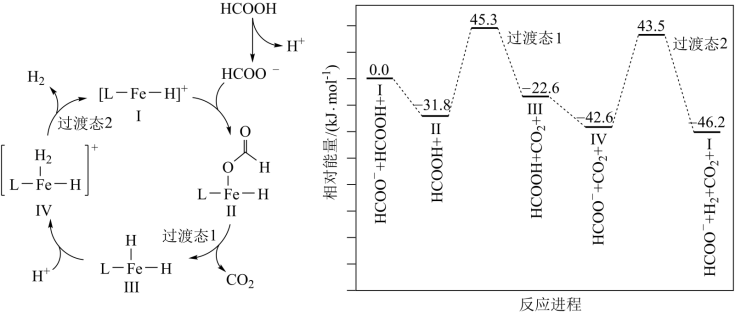
下列说法错误的是
 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是
A.该过程的总反应为 |
B. 浓度过大或者过小,均导致反应速率降低 浓度过大或者过小,均导致反应速率降低 |
C.该催化循环中 元素的化合价发生了变化 元素的化合价发生了变化 |
| D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定 |
您最近一年使用:0次
2021-06-09更新
|
9145次组卷
|
39卷引用:江苏省如皋中学2021-2022学年高三上学期期初测试化学试题
江苏省如皋中学2021-2022学年高三上学期期初测试化学试题(已下线)2020年山东卷化学高考真题变式题11-152021年新高考湖南化学高考真题(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)安徽省合肥工业大学附属中学2021-2022学年高三上学期第一次阶段考试化学试题辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)2021年湖南省高考化学试卷变式题11-19北京市第八中学2021-2022学年高二上学期期中考试化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题10 化学反应与能量-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)卷10 化学反应机理选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)秘籍08 反应历程探究与催化原理图象分析-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题09 化学反应速率、化学平衡-三年(2020-2022)高考真题分项汇编(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)江苏省海安高级中学2021-2022学年高二上学期阶段测试(二)化学试题(已下线)第15讲 化学反应的热效应 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题36 高考“明星”考点—催化剂-备战2023年高考化学一轮复习考点微专题(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题湖南省衡阳师范学院祁东附属中学2021-2022学年高三上学期12月月考化学试题(已下线)专题12 化学反应机理(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用(已下线)素养卷02 循环转化过渡态理论图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)考点21 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题09 化学反应中的热效应与反应机理-2023年高考化学真题题源解密(全国通用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)热点题型训练 催化剂与反应历程(机理)(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山东省泰安市部分学校2023-2024学年高二上学期期末调研化学试题北京大学附属中学2021-2022学年高二下学期期末考试化学试卷(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题山东省威海市乳山市银滩高级中学2023-2024学年高二上学期1月模块考试化学试题
2021·四川达州·二模
名校
解题方法
3 . 用FeCl3、CuCl2的混合溶液作吸收剂可吸收工厂排放的含H2S的废气,从而减少空气污染并回收S,其过程如图所示(各步均进行完全)。下列叙述正确的是
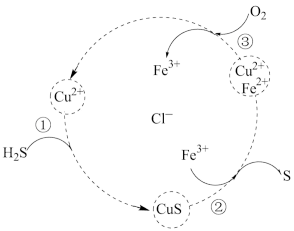

| A.①反应的离子方程式为: S2-+Cu2+= CuS |
| B.在转化过程中化合价没有变化的元素只有H |
| C.回收32gS时,理论上需要消耗标准状况O211.2 L |
| D.吸收剂吸收前后混合溶液中Fe3+、Cu2+浓度不变 |
您最近一年使用:0次
2021-05-31更新
|
1105次组卷
|
5卷引用:2021年秋季高三化学开学摸底考试卷03(广东专用)



