1 . 目前工业合成氨的原理: 。回答下列问题:
。回答下列问题:
(1)已知反应:①
②
则
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
(2)在某一密闭容器中进行反应 。
。
①图1中表示 的物质的量浓度随时间变化的曲线是
的物质的量浓度随时间变化的曲线是_______ (填标号)。

②图2中, 时刻,发生改变的条件可能为
时刻,发生改变的条件可能为_______ ;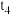 时刻,发生改变的条件可能为
时刻,发生改变的条件可能为_______ 。

③图2中氨气的含量最高的是_______ (填“ ”、“
”、“ ”、“
”、“ ”、“
”、“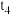 ”、“
”、“ ”或“
”或“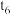 ”)时刻。
”)时刻。
(3)在恒温恒容密闭容器中进行工业合成氨模拟实验,下列说法正确的是_______ (填标号)。
A.往该密闭容器中通入少量稀有气体,正、逆反应速率均加快
B.每断裂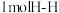 键,同时断裂
键,同时断裂 键,该反应达到平衡
键,该反应达到平衡
C.增大 的物质的量,
的物质的量, 的转化率增大
的转化率增大
 。回答下列问题:
。回答下列问题:(1)已知反应:①

②

则

 、
、 的代数式表示)。
的代数式表示)。(2)在某一密闭容器中进行反应
 。
。①图1中表示
 的物质的量浓度随时间变化的曲线是
的物质的量浓度随时间变化的曲线是
②图2中,
 时刻,发生改变的条件可能为
时刻,发生改变的条件可能为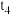 时刻,发生改变的条件可能为
时刻,发生改变的条件可能为
③图2中氨气的含量最高的是
 ”、“
”、“ ”、“
”、“ ”、“
”、“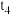 ”、“
”、“ ”或“
”或“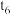 ”)时刻。
”)时刻。(3)在恒温恒容密闭容器中进行工业合成氨模拟实验,下列说法正确的是
A.往该密闭容器中通入少量稀有气体,正、逆反应速率均加快
B.每断裂
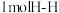 键,同时断裂
键,同时断裂 键,该反应达到平衡
键,该反应达到平衡C.增大
 的物质的量,
的物质的量, 的转化率增大
的转化率增大
您最近一年使用:0次
2 . 碳化学为人类发展做出巨大的贡献的同时也给环境带来了重大的危害。
(1)环戊二烯(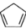 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
已知: (g)
(g)

 ①
①
 ②
②
对于反应:
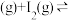

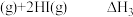 ③
③
则反应③___________ (填“低温自发”、“高温自发”或者“任意条件均自发”),理由为___________ 。
(2)目前,“低碳经济”备受关注, 的转化和利用是一个热门的研究课题。
的转化和利用是一个热门的研究课题。
已知: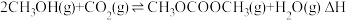 。在两个密闭容器中分别投入
。在两个密闭容器中分别投入 和
和 直接合成碳酸二甲酯
直接合成碳酸二甲酯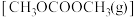 ,一定条件下,反应达到平衡时
,一定条件下,反应达到平衡时 的转化率如图1所示,则:
的转化率如图1所示,则:
①
___________ 0(填“>”、“<”或“=”,下同),
___________  。
。
②A点对应容器体积为 ,A点的平衡常数
,A点的平衡常数
___________  。
。
③下列能说明此反应已达到平衡状态的是___________ (填标号)。
A. B.
B. 与
与 的物质的量之比保持不变
的物质的量之比保持不变
C.恒压条件下,混合气体的密度保持不变 D.碳酸二甲酯的物质的量分数保持不变
(3) 经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:
反应Ⅱ: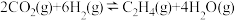
为分析催化剂对反应的选择性,在密闭容器中充入 和
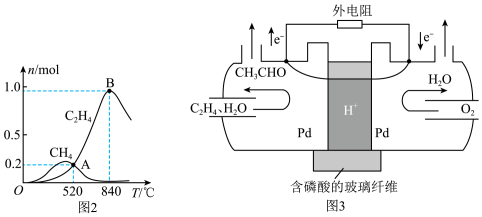
和 ,测得有关物质的物质的量随温度变化如图2所示。该催化剂在较高温度时主要选择
,测得有关物质的物质的量随温度变化如图2所示。该催化剂在较高温度时主要选择___________ (填“反应Ⅰ”或“反应Ⅱ”)。 时,反应达到平衡时气体压强为
时,反应达到平衡时气体压强为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
___________  。(
。( 为用分压表示的平衡常数,分压=总压×物质的量分数)
为用分压表示的平衡常数,分压=总压×物质的量分数)
(4)有机电化学有条件温和,对环境友好,产品纯净等优点,其越来越受到人们的重视,一种以乙烯为原料一步合成乙醛的电化学装置如图3所示:
该装置负极上的电极反应式为___________ 。
(1)环戊二烯(
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:已知:
 (g)
(g)

 ①
① ②
②对于反应:

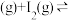

 ③
③则反应③
(2)目前,“低碳经济”备受关注,
 的转化和利用是一个热门的研究课题。
的转化和利用是一个热门的研究课题。已知:
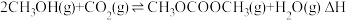 。在两个密闭容器中分别投入
。在两个密闭容器中分别投入 和
和 直接合成碳酸二甲酯
直接合成碳酸二甲酯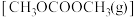 ,一定条件下,反应达到平衡时
,一定条件下,反应达到平衡时 的转化率如图1所示,则:
的转化率如图1所示,则:①


 。
。②A点对应容器体积为
 ,A点的平衡常数
,A点的平衡常数
 。
。③下列能说明此反应已达到平衡状态的是

A.
 B.
B. 与
与 的物质的量之比保持不变
的物质的量之比保持不变C.恒压条件下,混合气体的密度保持不变 D.碳酸二甲酯的物质的量分数保持不变
(3)
 经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
经催化加氢可以生成低碳烃,主要有以下两个竞争反应:反应Ⅰ:

反应Ⅱ:
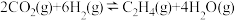
为分析催化剂对反应的选择性,在密闭容器中充入
 和
和 ,测得有关物质的物质的量随温度变化如图2所示。该催化剂在较高温度时主要选择
,测得有关物质的物质的量随温度变化如图2所示。该催化剂在较高温度时主要选择 时,反应达到平衡时气体压强为
时,反应达到平衡时气体压强为 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
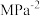 。(
。( 为用分压表示的平衡常数,分压=总压×物质的量分数)
为用分压表示的平衡常数,分压=总压×物质的量分数)
(4)有机电化学有条件温和,对环境友好,产品纯净等优点,其越来越受到人们的重视,一种以乙烯为原料一步合成乙醛的电化学装置如图3所示:
该装置负极上的电极反应式为
您最近一年使用:0次
2021-11-20更新
|
357次组卷
|
2卷引用:贵州省毕节市金沙县2022届高三上学期11月月考理科综合化学试题
解题方法
3 . 当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发 利用技术、降低空气中
利用技术、降低空气中 含量成为了研究热点。为减少
含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。
对环境造成的影响,可采用以下方法将其资源化利用。
(1) 催化加氢制甲醇
催化加氢制甲醇
一定温度下,在某恒容密闭容器中充入一定量的 和
和 ,发生反应:
,发生反应: 。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
(2) 催化加氢合成乙烯
催化加氢合成乙烯
在 某恒容密闭容器中,充入
某恒容密闭容器中,充入 和
和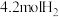 ,发生反应:
,发生反应: 。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

①该反应的
_______ (填“>”或“<”)0,曲线Ⅰ和曲线Ⅱ分别表示_______ (填化学式,下同)和_______ 的变化曲线。
②根据图中a点,计算该温度下平衡时的
_______  ,
,
_______  ,
, 的平衡转化率为
的平衡转化率为_______  (保留三位有效数字)。
(保留三位有效数字)。
③若平衡时a点容器内气体的总压强为 ,则该反应的平衡常数
,则该反应的平衡常数
_______  (列出计算式,用分压表示,分压
(列出计算式,用分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
(3) 用途广泛,写出其基于物理性质的一种用途:
用途广泛,写出其基于物理性质的一种用途:_______ 。
 利用技术、降低空气中
利用技术、降低空气中 含量成为了研究热点。为减少
含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。
对环境造成的影响,可采用以下方法将其资源化利用。(1)
 催化加氢制甲醇
催化加氢制甲醇一定温度下,在某恒容密闭容器中充入一定量的
 和
和 ,发生反应:
,发生反应: 。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。| A.混合气体的密度不再随时间变化而改变 |
| B.气体的压强不再随时间变化而改变 |
C. 的物质的量分数不再随时间变化而改变 的物质的量分数不再随时间变化而改变 |
D.单位时间内每形成 键,同时断裂 键,同时断裂 键 键 |
 催化加氢合成乙烯
催化加氢合成乙烯在
 某恒容密闭容器中,充入
某恒容密闭容器中,充入 和
和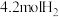 ,发生反应:
,发生反应: 。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
①该反应的

②根据图中a点,计算该温度下平衡时的

 ,
,
 ,
, 的平衡转化率为
的平衡转化率为 (保留三位有效数字)。
(保留三位有效数字)。③若平衡时a点容器内气体的总压强为
 ,则该反应的平衡常数
,则该反应的平衡常数
 (列出计算式,用分压表示,分压
(列出计算式,用分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。(3)
 用途广泛,写出其基于物理性质的一种用途:
用途广泛,写出其基于物理性质的一种用途:
您最近一年使用:0次
2021-10-21更新
|
119次组卷
|
3卷引用:贵州省遵义市2021-2022学年高二上学期期中质量检测化学试题
4 . CO2的捕集、利用与封存成为科学家研究的重要课题。
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ·mol-1
则反应 3CO2(g)+CH4(g)=4CO(g)+2H2O(g)的ΔH3=___________ kJ·mol-1。
(2)探究反应 CO2(g)+CH4(g)=2CO(g)+2H2(g)的反应速率和平衡,向1L恒容密闭容器中通入CO2和CH4各1mol,测得CH4的平衡转化率与温度及压强的关系如图所示。

①CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH___________ 0(填“大于”或“小于”)。
②下列叙述能判断反应CO2(g)+CH4(g)=2CO(g)+2H2(g)达化学平衡状态的是___________ 。
A.混合气体的密度保持不变
B.CO的体积分数保持不变
C.c(CO)和c(H2)的比值保持不变
D.断裂4mol C-H键的同时断裂2mol H-H键
③在压强为P1,温度为1000℃时,反应经5min达平衡,用CO2表示的化学反应速率v(CO2)=____ ;比较x点和y点的速率:x____ y(填“大于”“小于”或“等于”);压强P1___________ P2(填“大于”“小于”或“等于”),原因是___________ 。
(3)CO2可被 NaOH 溶液捕获,其所得溶液中c(HCO ):c(CO
):c(CO )=2:1,溶液pH=
)=2:1,溶液pH=______ 。(室温下,H2CO3的K1=4x10-7;K2=5x10-11)
(1)已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ·mol-1
则反应 3CO2(g)+CH4(g)=4CO(g)+2H2O(g)的ΔH3=
(2)探究反应 CO2(g)+CH4(g)=2CO(g)+2H2(g)的反应速率和平衡,向1L恒容密闭容器中通入CO2和CH4各1mol,测得CH4的平衡转化率与温度及压强的关系如图所示。

①CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH
②下列叙述能判断反应CO2(g)+CH4(g)=2CO(g)+2H2(g)达化学平衡状态的是
A.混合气体的密度保持不变
B.CO的体积分数保持不变
C.c(CO)和c(H2)的比值保持不变
D.断裂4mol C-H键的同时断裂2mol H-H键
③在压强为P1,温度为1000℃时,反应经5min达平衡,用CO2表示的化学反应速率v(CO2)=
(3)CO2可被 NaOH 溶液捕获,其所得溶液中c(HCO
 ):c(CO
):c(CO )=2:1,溶液pH=
)=2:1,溶液pH=
您最近一年使用:0次
5 . 研究CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题;
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1
CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1
反应II:CH3OCH3(g)+H2O(g) 2CH3OH(g) ∆H2= +23.4 kJ•mol-1
2CH3OH(g) ∆H2= +23.4 kJ•mol-1
反应III:2CO2(g)+ 6H2(g) CH3OCH3(g)+3H2O(g) ∆H3
CH3OCH3(g)+3H2O(g) ∆H3
(1)△H3=___________ kJ•mol-1,据此判断该反应在___________ (填“低温”、高温或“任意温度”)条件下能自发进行。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I能说明反应I达到平衡状态的是___________ (填字母序号)。
a.容器内混合气体的密度保持不变 b.消耗3molH2的同时生成1 mol H2O
c.反应体系总压强保持不变 d. CH3OH和CO2的物质的量之比保持不变
(3) T1K时,将1 mol二甲醚充入某恒容容器中,发生如下分解反应:
CH3OCH3(g) CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
由表中数据计算:反应达平衡时,二甲醚的分解率为___________ ,该温度下的平衡常数Kp=___________ (kPa)2. (Kp为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)
(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。

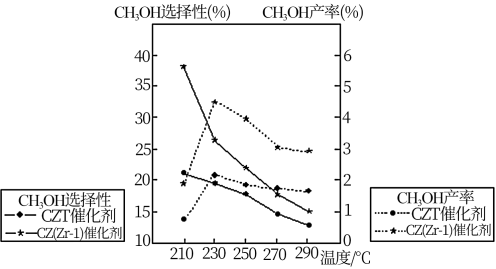
①温度高于230°C,CH3OH产率随温度升高而下降的原因是___________ 。
②在上述条件下合成甲醇的工业条件是___________ 。
a.230℃催化剂CZT b.210℃催化剂CZT
c.230℃催化剂 CZ(Zr-1)T d. 210℃催化剂CZ(Zr-1)T
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1
CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1反应II:CH3OCH3(g)+H2O(g)
 2CH3OH(g) ∆H2= +23.4 kJ•mol-1
2CH3OH(g) ∆H2= +23.4 kJ•mol-1反应III:2CO2(g)+ 6H2(g)
 CH3OCH3(g)+3H2O(g) ∆H3
CH3OCH3(g)+3H2O(g) ∆H3(1)△H3=
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I能说明反应I达到平衡状态的是
a.容器内混合气体的密度保持不变 b.消耗3molH2的同时生成1 mol H2O
c.反应体系总压强保持不变 d. CH3OH和CO2的物质的量之比保持不变
(3) T1K时,将1 mol二甲醚充入某恒容容器中,发生如下分解反应:
CH3OCH3(g)
 CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:| 反应时间t/min | 0 | 5 | 10 | 15 | 20 | ∞ |
| 气体总压p总/kPa | 10.0 | 13.6 | 15.8 | 17.7 | 18.9 | 20.0 |
(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。


①温度高于230°C,CH3OH产率随温度升高而下降的原因是
②在上述条件下合成甲醇的工业条件是
a.230℃催化剂CZT b.210℃催化剂CZT
c.230℃催化剂 CZ(Zr-1)T d. 210℃催化剂CZ(Zr-1)T
您最近一年使用:0次
6 . 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:

回答下列问题:
①写出反应I的热化学方程式_________ 。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g) 2NO2(g)反应速率的是
2NO2(g)反应速率的是_______ (填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________ (反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:

①T℃时,该反应的平衡常数为_____________________ (保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________ 。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______ v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g) N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________ ;在上图标出点中,指出能表示反应达到平衡状态的点是___ ,理由是________ 。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)
 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
回答下列问题:
①写出反应I的热化学方程式
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)
 2NO2(g)反应速率的是
2NO2(g)反应速率的是(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
①T℃时,该反应的平衡常数为
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正
(3)NO2存在如下平衡:2NO2(g)
 N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=
您最近一年使用:0次
2020-01-15更新
|
508次组卷
|
8卷引用:贵州省威宁县第八中学2021-2022学年高三上学期第一次月考化学试题
贵州省威宁县第八中学2021-2022学年高三上学期第一次月考化学试题山东省泰安市2020届高三上学期期末考试化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点10-12)河北省石家庄市第二中学2020届高三下学期教学质量检测模拟考试理综化学试题江西省南昌市新建区第二中学2020届高三下学期第四次线上测试(全国I卷)理综化学试题(已下线)考点08 化学反应速率及其影响因素-2020年高考化学命题预测与模拟试题分类精编(已下线)考点10 化学平衡常数及其图象分析-2020年高考化学命题预测与模拟试题分类精编西藏自治区拉萨市拉萨中学2020届高三第七次月考试理综化学试题



