13-14高三·湖北省直辖县级单位·阶段练习
1 . Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:

(1)该合成路线对于环境保护的价值在于______ 。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因______ 。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:______ 。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
CH3OCH3(g) + 3H2O(g)。已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
(4)该反应的焓变△H______ 0,熵变△S______ 0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式______ 。
(6)若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜______ g。

(1)该合成路线对于环境保护的价值在于
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g) + 6H2(g)
 CH3OCH3(g) + 3H2O(g)。已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
CH3OCH3(g) + 3H2O(g)。已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
(4)该反应的焓变△H
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式
(6)若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜
您最近一年使用:0次
名校
解题方法
2 . 随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=_____ kJ·mol-1。
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是____ kJ。
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
则该反应的ΔH=____ kJ·mol-1。
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。
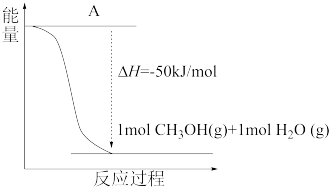
补全上图:图中A处应填入_______ 。
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。
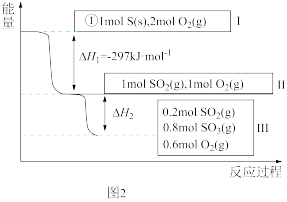
已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:____ 。
②ΔH2=___ kJ·mol-1。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI(g)+H2SO4(l) ΔH1=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH2=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH3=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH=
(2)硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,工业制备纯硅的反应为2H2(g)+SiCl4(g)=Si(s)+4HCl(g) ΔH=+240.4kJ·mol-1。若将生成的HCl通入100mL1mol·L-1的NaOH溶液中恰好完全反应,则在此制备纯硅反应过程中的热效应是
(3)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g)ΔH。表中所列为常见化学键的键能数据:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ·mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图1所示。

补全上图:图中A处应填入
(5)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图2所示。

已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6 kJ·mol-1
①写出能表示硫的燃烧热的热化学方程式:
②ΔH2=
您最近一年使用:0次
2020-11-26更新
|
192次组卷
|
4卷引用:湖北省黄州中学(黄冈市外国语学校)2023-2024学年高二上学期9月月考化学试题
3 . 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。
(1)写出甲醚燃烧的热化学方程式_______________________________________ ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+6H2(g)+O2(g)==2CH3OCH3 (g)的反应热为_________________ ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
______ (选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将
________ (填“变大”、“变小”或“不变”,下同),混合气体的平均式量将__________ ;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为____________________ ;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:

请写出电解过程中Y电极附近观察到的现象_______________________________ ;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH=__________ (假设溶液的体积不变,气体全部从溶液中逸出)。
(1)写出甲醚燃烧的热化学方程式
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)
 CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:

请写出电解过程中Y电极附近观察到的现象
您最近一年使用:0次



