名校
解题方法
1 . 反应A(g)+B(g) = C(g) ΔH,分两步进行:①A(g)+B(g) = X(g)ΔH1 (慢)②X(g) = C(g) ΔH2(快)反应过程中能量变化如下图所示,下列说法正确的是


| A.ΔH1+ ΔH2=ΔH >0 | B.E2表示反应C(g) =X (g)的活化能 |
| C.E1是反应①的反应热 | D.整个反应的速率快慢由反应②决定 |
您最近一年使用:0次
2019-12-25更新
|
134次组卷
|
2卷引用:福建省漳平市第一中学2019-2020学年高二上学期第二次月考化学试题
解题方法
2 . 工业上可用水煤气(CO和H2)合成一系列有机物。
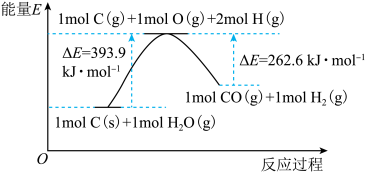
(1)根据下图写出固态碳和水蒸气反应生成CO和H2的热化学方程式:_________________________________________________ 。
(2)已知
① 2H2 (g)+CO(g) CH3OH (g) ΔH1
CH3OH (g) ΔH1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
③ CO(g)+H2O(g) CO2 (g)+H2(g) ΔH3
CO2 (g)+H2(g) ΔH3
则3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g) ΔH=
CH3OCH3(g)+CO2 (g) ΔH=_________ (用ΔH1、 ΔH2、ΔH3列出表达式)。
(3)一定条件下的密闭容器中,3H2(g)+3CO(g) CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
反应达到平衡后,要提高CO的转化率,可以采取的措施是______ (填字母代号)。
A.高温 B.加入催化剂 C.高压 D.分离出二甲醚
(4)已知2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________ 。
③达到平衡后CH3OH的浓度为_____________ 。
(1)根据下图写出固态碳和水蒸气反应生成CO和H2的热化学方程式:

(2)已知
① 2H2 (g)+CO(g)
 CH3OH (g) ΔH1
CH3OH (g) ΔH1② 2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2③ CO(g)+H2O(g)
 CO2 (g)+H2(g) ΔH3
CO2 (g)+H2(g) ΔH3则3H2(g)+3CO(g)
 CH3OCH3(g)+CO2 (g) ΔH=
CH3OCH3(g)+CO2 (g) ΔH=(3)一定条件下的密闭容器中,3H2(g)+3CO(g)
 CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)
CH3OCH3(g)+CO2 (g) ΔH=a kJ·mol-1 (a<0)反应达到平衡后,要提高CO的转化率,可以采取的措施是
A.高温 B.加入催化剂 C.高压 D.分离出二甲醚
(4)已知2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.4 | 0.1 | 0.1 |
①此时,反应向
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为
③达到平衡后CH3OH的浓度为
您最近一年使用:0次
名校
解题方法
3 . 二氧化碳在石油开采、人工降雨、消防、有机合成等领域有着广泛的应用。
(1)甲醇是重要的化工原料。利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,已知反应相关的化学键键能数据如下:
写出CO2和H2在催化剂作用下生成CH3OH(g)和H2O(g)的热化学方程式________
(2)CH4超干重整CO2的催化转化原理示意图如图所示:
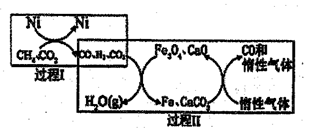
①过程Ⅰ,生成1molH2时吸收123.5kJ热量,其热化学方程式是_______
②过程Ⅱ,实现了含然物种与含碳物种的分离,生成H2O(g)的化学方程式是________
(1)甲醇是重要的化工原料。利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,已知反应相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(KJ/mol) | 436 | 343 | 803 | 465 | 413 |
写出CO2和H2在催化剂作用下生成CH3OH(g)和H2O(g)的热化学方程式
(2)CH4超干重整CO2的催化转化原理示意图如图所示:

①过程Ⅰ,生成1molH2时吸收123.5kJ热量,其热化学方程式是
②过程Ⅱ,实现了含然物种与含碳物种的分离,生成H2O(g)的化学方程式是
您最近一年使用:0次
解题方法
4 . 运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
②P(红磷,s)+ O2(g)=
O2(g)= P4O10(s) ΔH=-738.5kJ·mol-1
P4O10(s) ΔH=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
②P(红磷,s)+
 O2(g)=
O2(g)= P4O10(s) ΔH=-738.5kJ·mol-1
P4O10(s) ΔH=-738.5kJ·mol-1则白磷转化为红磷的热化学方程式为
| A.P4(白磷,s)=4P(红磷,s) △H=-29.2kJ·mol-1 |
| B.P4(白磷,s)=4P(红磷,s) △H=+29.2kJ·mol-1 |
| C.P4(白磷,s)=4P(红磷,s) △H=-2244.7kJ·mol-1 |
| D.P4(白磷,s)=4P(红磷,s) △H=+2244.7kJ·mol-1 |
您最近一年使用:0次
2016-12-09更新
|
493次组卷
|
5卷引用:2015届福建省福州市高三上学期期末考试化学试卷
11-12高二上·福建福州·阶段练习
名校
解题方法
5 . 已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H1kJ·mol﹣1; H2O(g)=H2O(1) △H2kJ·mol﹣1; C2H5OH(g)=C2H5OH(1) △H3kJ·mol﹣1,若使23 g C2H5OH(1)完全燃烧生成H2O(1),则放出的热量为______________
您最近一年使用:0次
10-11高三上·福建漳州·阶段练习
解题方法
6 . 按要求填空:
(1)已知:在1×105Pa条件下,氢气的标准燃烧热是285.8 kJ·mol-1,下列热化学方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2(g)ΔH=+285.8kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l)ΔH=—517.6kJ·mol-1
C. H2(g)+1/2 O2(g)=H2O(g)ΔH=—285.8kJ·mol-1-
D. 2H2(g)+O2(g)=2H2O(l)ΔH=+517.6J·mol-1
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
① P4(s,白磷)+ 5O2(g)=P4O10(s); ΔH=—2983.2kJ·mol-1
② P(s,红磷)+ 5/4 O2(g) =1/4 P4O10(s); ΔH=—738.5kJ·mol-1-
则白磷转化为红磷的热化学方程式_________________________________ 。相同的状况下,能量较低的是_________ ;白磷的稳定性比红磷___________ (填“高”或“低”)。
(1)已知:在1×105Pa条件下,氢气的标准燃烧热是285.8 kJ·mol-1,下列热化学方程式正确的是
A. H2O(g)=H2(g)+1/2O2(g)ΔH=+285.8kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l)ΔH=—517.6kJ·mol-1
C. H2(g)+1/2 O2(g)=H2O(g)ΔH=—285.8kJ·mol-1-
D. 2H2(g)+O2(g)=2H2O(l)ΔH=+517.6J·mol-1
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
① P4(s,白磷)+ 5O2(g)=P4O10(s); ΔH=—2983.2kJ·mol-1
② P(s,红磷)+ 5/4 O2(g) =1/4 P4O10(s); ΔH=—738.5kJ·mol-1-
则白磷转化为红磷的热化学方程式
您最近一年使用:0次



