名校
解题方法
1 . 完成下列问题。
(1)某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下系列实验:
(1)①写出硫代硫酸钠与稀硫酸反应的化学方程式:_______ 。
②该实验①、②可探究_______ 对反应速率的影响,因此V3是_______ ;实验①、③可探究_______ 对反应速率的影响,因此V5是_______ 。
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
①该反应的化学平衡常数表达式为K=_______ 。
②该反应为_______ 反应(填“吸热”或“放热”)。
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为_______ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向_______ (填“正向”或“逆向”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_______ ΔH2(填“>”或“<”)。
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(1)某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下系列实验:
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)①写出硫代硫酸钠与稀硫酸反应的化学方程式:
②该实验①、②可探究
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=
②该反应为
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
您最近一年使用:0次
2022-08-29更新
|
169次组卷
|
2卷引用:福建省三明第一中学2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
2 . 根据下列信息判断N2和O2反应生成NO时的能量变化。下列说法正确的是
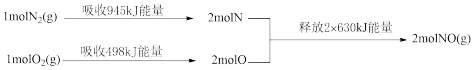
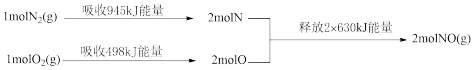
| A.NO(g)分解为N2(g)与O2(g)时需要释放能量 |
| B.N2(g)和O2(g)反应生成1molNO(g)时放出能量630kJ |
| C.断开氧氧键形成1mol氧原子需要吸收能量498kJ |
| D.1mol N2(g)的能量高于1mol NO(g) |
您最近一年使用:0次
2022-07-06更新
|
413次组卷
|
2卷引用:福建省厦门市2021-2022学年高一下学期期末考试化学试题
名校
解题方法
3 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,请回答下列问题:
(1)用 催化还原
催化还原 可以消除氮氧化物的污染,例如:
可以消除氮氧化物的污染,例如:

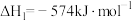

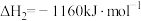
写出1mol 还原
还原 生成
生成 、
、 和气态水的热化学方程式
和气态水的热化学方程式_______ 。
(2)合成氨工业在国民生产中有重要意义。在容积为2L的恒温密闭容器中加入0.1mol的 和0.3mol的
和0.3mol的 在一定条件下发生反应:
在一定条件下发生反应:
 ,在5min时反应恰好达到平衡,此时测得
,在5min时反应恰好达到平衡,此时测得 的物质的量为0.1mol。
的物质的量为0.1mol。
①这段时间内用 表示的反应速率为
表示的反应速率为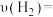
_______ 
②平衡后,若要再提高反应速率,且增大 的产率,可以采取的措施有
的产率,可以采取的措施有_______ 。(答一条即可)
③下列各项能作为判断该反应达到化学平衡状态的依据是_______ (填序号字母)。
A.容器内 、
、 、
、 的物质的量浓度之比为1:3:2
的物质的量浓度之比为1:3:2
B.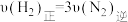
C.混合气体的密度保持不变
D.容器内压强保持不变
(3)已知合成氨反应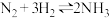 在400℃时的平衡常数
在400℃时的平衡常数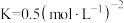 。在400℃时,测得某时刻
。在400℃时,测得某时刻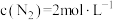 、
、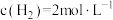 、
、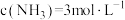 ,此时刻该反应的
,此时刻该反应的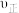
_______ 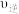 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(4)如图表示合成氨在恒压密闭容器中,不同温度下,达到平衡时 的体积百分数与投料比[
的体积百分数与投料比[ ]的关系。
]的关系。
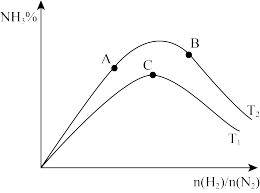
由此判断 、
、 、
、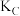 的大小关系为:
的大小关系为:_______ 。
(1)用
 催化还原
催化还原 可以消除氮氧化物的污染,例如:
可以消除氮氧化物的污染,例如:
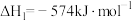

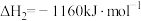
写出1mol
 还原
还原 生成
生成 、
、 和气态水的热化学方程式
和气态水的热化学方程式(2)合成氨工业在国民生产中有重要意义。在容积为2L的恒温密闭容器中加入0.1mol的
 和0.3mol的
和0.3mol的 在一定条件下发生反应:
在一定条件下发生反应:
 ,在5min时反应恰好达到平衡,此时测得
,在5min时反应恰好达到平衡,此时测得 的物质的量为0.1mol。
的物质的量为0.1mol。①这段时间内用
 表示的反应速率为
表示的反应速率为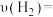

②平衡后,若要再提高反应速率,且增大
 的产率,可以采取的措施有
的产率,可以采取的措施有③下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内
 、
、 、
、 的物质的量浓度之比为1:3:2
的物质的量浓度之比为1:3:2B.
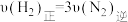
C.混合气体的密度保持不变
D.容器内压强保持不变
(3)已知合成氨反应
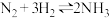 在400℃时的平衡常数
在400℃时的平衡常数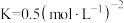 。在400℃时,测得某时刻
。在400℃时,测得某时刻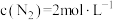 、
、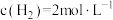 、
、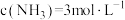 ,此时刻该反应的
,此时刻该反应的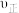
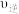 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(4)如图表示合成氨在恒压密闭容器中,不同温度下,达到平衡时
 的体积百分数与投料比[
的体积百分数与投料比[ ]的关系。
]的关系。
由此判断
 、
、 、
、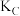 的大小关系为:
的大小关系为:
您最近一年使用:0次
2022-05-10更新
|
289次组卷
|
3卷引用:福建省莆田第一中学2021-2022学年高二下学期期中考试化学试题
4 . 某化学兴趣小组进行了实验:向2支试管中分别加入0.5 g Na2CO3固体和0.5 gNaHCO3固体,再分别加入30 mL 0.3 mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论:CO (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?_____ (填“甲”或“乙”) ,理由是_______ 。
(2)查阅资料:
反应I :CO (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
反应II :HCO (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
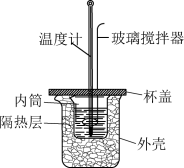
(3)该化学兴趣小组用如图所示装置设计了实验,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______________ 。
②表格二对应实验得出的结论是________________ 。
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1______ (填“>”、“< ”或“=”,下同) △H3,△H2______ △H4。
 (aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO
(aq) +2H+ (aq)=H2O(1) +CO2(g)△H1<0, HCO (aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq)=H2O(1) +CO2(g) △H2>0。回答下列问题:(1)乙同学认为该实验不一定能得到甲同学的结论,你支持谁的观点?
(2)查阅资料:
反应I :CO
 (aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;
(aq) +2H+ (aq)=H2O(l) +CO2(g) △H1= -12.14kJ· mol-1;反应II :HCO
 (aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。
(aq) +H+ (aq)=H2O(l) +CO2(g) △H2= +12.64 kJ·mol-1。向V mLc mol· L-1碳酸钠溶液中,逐滴加入2V mLc mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是 (填标号)。
A.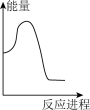 | B.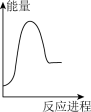 | C.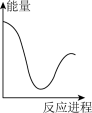 | D.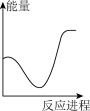 |

表格一:
试剂1 | 试剂2混合前温度/℃ | 混合后温度/℃ |
0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
表格二:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22. 3 | 19.0 | 10mL H2O 19.0 | 19.0 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL H2O 19.0 | 19.0 |
表格三:
试剂1 | 试剂2混合 前温度/℃ | 溶解后温 度/℃ | 静置后的 温度/℃ | 试剂3混合 前温度/℃ | 混合后 温度/℃ |
0.5 g Na2CO3 | 10 mL H2O19.0 | 22.3 | 19.0 | 10mL HCl 19.0 | 20.5 |
0.5 g NaHCO3 | 10 mL H2O19.0 | 17.5 | 19.0 | 10 mL HCl19.0 | 18.3 |
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应III:Na2CO3(s) +2H+ (aq)=2Na+ (aq) +H2O(1) +CO2(g) △H3;
反应IV:NaHCO3(s)+ H+ (aq)=Na+ (aq) + H2O(l) +CO2(g) △H4。
则△H1
您最近一年使用:0次
10-11高三上·山西吕梁·阶段练习
名校
解题方法
5 . 已知H2O(g)=H2O(1) ΔH=-Q1kJ•mol-1,
C2H5OH(g)=C2H5OH(1) ΔH=-Q2kJ•mol-1,
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q3kJ•mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 kJ
C2H5OH(g)=C2H5OH(1) ΔH=-Q2kJ•mol-1,
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-Q3kJ•mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 kJ
| A.Q1+Q2+Q3 | B.0.5(Q1+Q2+Q3) |
| C.0.5Q1-1.5Q2+0.5Q3 | D.1.5Q1-0.5Q2+0.5Q3 |
您最近一年使用:0次
2021-12-26更新
|
2117次组卷
|
31卷引用:2011届福建省三明一中高三上学期期中考试化学卷
(已下线)2011届福建省三明一中高三上学期期中考试化学卷(已下线)2011届山西省汾阳中学高三上学期第二次月考化学卷(已下线)2011-2012学年安徽省安工大附中、红星中学高二3月联考化学试卷(已下线)2011-2012学年浙江省嘉兴一中高二下学期期中考试化学试卷(已下线)2011-2012学年江西省白鹭洲中学高一下学期期中考试化学试卷(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试2化学试卷高二人教版选修4 第一章 第三节 化学反应热的计算吉林省白城市通榆县第一中学2019-2020学年高二上学期第一次月考化学试题吉林省吉林地区普通高中友好学校联合体第三十一届2019-2020学年高二上学期期中考试化学试题湖南省娄底市娄星区2019-2020学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第1节 化学反应的热效应吉林省长春汽车经济技术开发区第六中学2019-2020学年高一下学期期末考试化学试题内蒙古赤峰学院附属中学2020-2021学年高二上学期期中考试化学试题甘肃省会宁县第一中学2020-2021学年高二上学期期中考试化学(理)试题广东省台山市华侨中学2020-2021学年高二上学期第一次月考化学试题(已下线)【浙江新东方】高中化学20210304-004四川省南充高级中学2020-2021学年高一下学期期中考试化学试题重庆市第八中学2020-2021学年高一下学期期中考试化学试题吉林省白山市抚松县第一中学2021-2022学年高二上学期开学考试验收化学试题(已下线)第1章 化学反应与能量(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)广西百色中学2021-2022学年高二上学期第一次月考化学试题河南省范县第一中学2021-2022学年高二上学期第一次月考检测化学试题(已下线)1.2 反应热的计算(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题第一章 化学反应的热效应(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)山东省烟台招远市第二中学2022-2023学年高三9月月考化学试题河南省南阳市第一中学校2022-2023学年高二上学期第一次月考化学试题广东省汕头市潮南区龙岭中英文学校2023-2024学年高二上学期10月月考化学试题广西钦州市第四中学2023-2024学年高二上学期9月考试化学试卷江西省宜春市丰城市东煌学校2023-2024学年高二上学期1月期末化学试题山东省菏泽市鄄城县第一中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
6 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:___________ 。
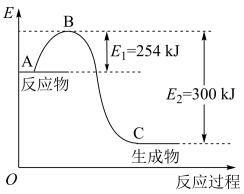
(2)已知化学键键能是形成或拆开1mol化学键放出或吸收的能量,单位kJ·mol-1.若已知下列数据:
试根据表中及图中数据计算N-H的键能为___________ kJ·mol-1.
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=___________ kJ·mol-1(用含a、b的式子表示)。
(1)下图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:

(2)已知化学键键能是形成或拆开1mol化学键放出或吸收的能量,单位kJ·mol-1.若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=
您最近一年使用:0次
2021-11-29更新
|
466次组卷
|
12卷引用:福建省泉州科技中学2020-2021学年高一下学期第一次月考化学试题
福建省泉州科技中学2020-2021学年高一下学期第一次月考化学试题湖北省监利县实验高中2017-2018学年高二上学期期中考试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1河北省保定市唐县第一中学2020-2021学年高二9月月考化学试题河南省豫南九校2020-2021学年高二上学期第二次联考化学试题海南省华中师范大学琼中附属中学2020-2021学年高二上学期期中考试化学试题江西省上高二中2020-2021学年高二上学期第三次月考化学试题宁夏吴忠中学2021-2022学年高二上学期期中考试化学试题山东省新泰市第二中学2021-2022学年上学期高二阶段性测试(一)化学试题宁夏回族自治区吴忠中学2021-2022学年高二上学期期中考试化学试题安徽省滁州市定远县育才学校2021-2022学年高二(普通班)下学期开学摸底考试化学试题(已下线)原理综合题解题策略
7 . 下图是合成氨反应和使用铁触媒作催化剂的催化历程。
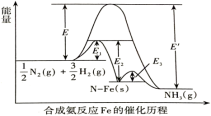
已知:① N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH1
NH3(g) ΔH1
② N2(g)+Fe(s)=N-Fe(s) ΔH2
N2(g)+Fe(s)=N-Fe(s) ΔH2
③N-FeS(s)+ H2(g)=NH3(g)+Fe(s) ΔH3
H2(g)=NH3(g)+Fe(s) ΔH3
下列说法正确的是

已知:①
 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g) ΔH1
NH3(g) ΔH1②
 N2(g)+Fe(s)=N-Fe(s) ΔH2
N2(g)+Fe(s)=N-Fe(s) ΔH2③N-FeS(s)+
 H2(g)=NH3(g)+Fe(s) ΔH3
H2(g)=NH3(g)+Fe(s) ΔH3下列说法正确的是
| A.反应①逆反应的活化能为E′ |
| B.ΔH2=E2-E1 |
| C.相同条件下,反应③的速率最慢 |
D.键能关系: E(N≡N)+ E(N≡N)+ E(H-H)>3E(N-H) E(H-H)>3E(N-H) |
您最近一年使用:0次
解题方法
8 . H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的•OH(羟基自由基),•OH可将有机物氧化降解。
(1)Cu2+—H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)=CuOOH+(aq)+H+(aq) △H1=akJ/mol
CuOOH+(aq)=Cu+(aq)+•OH(aq)+ O2(g) △H2=bkJ/mol
O2(g) △H2=bkJ/mol
2CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) △H3=ckJ/mol
则H2O2(aq)=2•OH(aq)△H=___ kJ•mol-1。
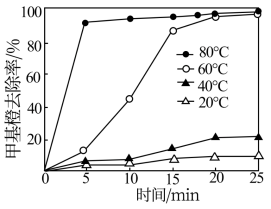
(2)为探究温度对Cu2+—H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除率增大,其原因是___ 。
(3)为探究Fe2+—Cu2+—H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+—Cu2+—H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为___ 。
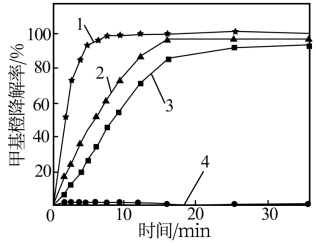
实验条件:200mL甲基橙模拟废水(1.5g•L-1,pH=3.0),温度60℃、V(H2O2)=2.0mL。
曲线1—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
曲线2—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
曲线3—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
曲线4—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
(1)Cu2+—H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)=CuOOH+(aq)+H+(aq) △H1=akJ/mol
CuOOH+(aq)=Cu+(aq)+•OH(aq)+
 O2(g) △H2=bkJ/mol
O2(g) △H2=bkJ/mol2CuOOH+(aq)=2Cu+(aq)+H2O2(aq)+O2(g) △H3=ckJ/mol
则H2O2(aq)=2•OH(aq)△H=
(2)为探究温度对Cu2+—H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除率增大,其原因是

(3)为探究Fe2+—Cu2+—H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+—Cu2+—H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为

实验条件:200mL甲基橙模拟废水(1.5g•L-1,pH=3.0),温度60℃、V(H2O2)=2.0mL。
曲线1—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
曲线2—V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
曲线3—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
曲线4—V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
您最近一年使用:0次
9 . Ⅰ.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
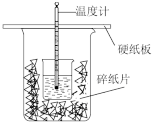
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________ ;由图可知此装置除了两烧杯没有填满碎泡沫塑料外,还有何不妥之处,应如何改正?___________ ;
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___________ (填“偏大”、“偏小”、“无影响”)。
Ⅱ.回答下列问题
(3)已知:①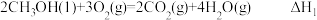 ,
,
②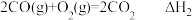 ,
,
③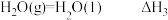 。
。
则反应 的
的 =
=___________ (用含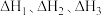 的式子表示)。
的式子表示)。
(4)某些化学键的键能如表所示:
试回答下列问题:
已知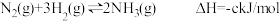 ,则N-H键的键能是
,则N-H键的键能是___________ kJ/mol (用含有a、b、c的式子表示)。
(5)1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中的能量变化如图所示,请写出NO2与CO反应的热化学方程式:___________ 。

(6)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷气体完全氧化生成CO2气体和液态水时放出热量50kJ,则表示丁烷燃烧热 的热化学方程式为___________ 。

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
Ⅱ.回答下列问题
(3)已知:①
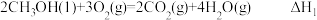 ,
,②
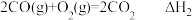 ,
,③
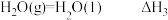 。
。则反应
 的
的 =
=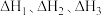 的式子表示)。
的式子表示)。(4)某些化学键的键能如表所示:
| 化学键 | H-H |  |
| 键能/(kJ/mol) | a | b |
已知
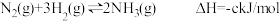 ,则N-H键的键能是
,则N-H键的键能是(5)1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中的能量变化如图所示,请写出NO2与CO反应的热化学方程式:

(6)家用液化气的主要成分之一是丁烷(C4H10)。常温常压条件下,1g丁烷气体完全氧化生成CO2气体和液态水时放出热量50kJ,则表示丁烷
您最近一年使用:0次
名校
解题方法
10 . 氨气是一种重要的化学物质,可用于制取化肥和硝酸,也可用于燃料电池等。
(1)工业合成氨的热化学方程式为: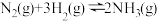
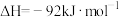
表中a为_______ 。
(2)合成氨原料中的 可用CO在高温下与水蒸气反应制得。已知在25℃、101kPa下:
可用CO在高温下与水蒸气反应制得。已知在25℃、101kPa下:
Ⅰ.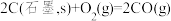
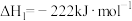
Ⅱ.
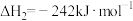
Ⅲ.

①25℃、101kPa下CO与水蒸气反应转化为 的热化学方程式为
的热化学方程式为_______ 。
②根据反应Ⅰ、Ⅱ、Ⅲ,下列说法正确的是_______ (填选项字母)。
a.由反应Ⅱ可以推知:
 ,则
,则 小于
小于
b.反应III的反应热等于 分子中化学键断裂时所吸收的总能量与
分子中化学键断裂时所吸收的总能量与 分子中化学键形成时所释放的总能量的差
分子中化学键形成时所释放的总能量的差
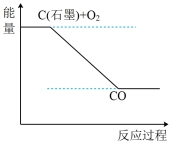
c.如图可表示反应Ⅰ的反应过程和能量的关系
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,氨燃料电池使用的电解质溶液是 的KOH溶液,生成的产物无污染。以此燃料电池,采用电解法制备
的KOH溶液,生成的产物无污染。以此燃料电池,采用电解法制备 ,装置如图所示。
,装置如图所示。
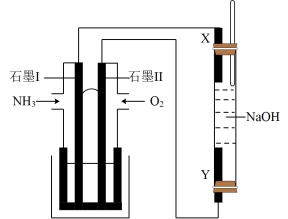
①石墨Ⅰ电极上的电极反应式为_______ 。
②Y电极的电极材料是_______ 。
③通电一段时间后,若右侧玻璃管中产生 白色沉淀,理论上石墨Ⅱ上通入
白色沉淀,理论上石墨Ⅱ上通入 的体积至少为
的体积至少为_______ L(标准状况下)。
(1)工业合成氨的热化学方程式为:
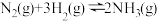
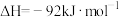
| 化学键 |  |  |  |
| 断开1mol化学键需要吸收的能量/kJ | a | 436 | 946 |
表中a为
(2)合成氨原料中的
 可用CO在高温下与水蒸气反应制得。已知在25℃、101kPa下:
可用CO在高温下与水蒸气反应制得。已知在25℃、101kPa下:Ⅰ.
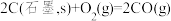
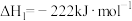
Ⅱ.

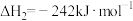
Ⅲ.


①25℃、101kPa下CO与水蒸气反应转化为
 的热化学方程式为
的热化学方程式为②根据反应Ⅰ、Ⅱ、Ⅲ,下列说法正确的是

a.由反应Ⅱ可以推知:

 ,则
,则 小于
小于
b.反应III的反应热等于
 分子中化学键断裂时所吸收的总能量与
分子中化学键断裂时所吸收的总能量与 分子中化学键形成时所释放的总能量的差
分子中化学键形成时所释放的总能量的差c.如图可表示反应Ⅰ的反应过程和能量的关系
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,氨燃料电池使用的电解质溶液是
 的KOH溶液,生成的产物无污染。以此燃料电池,采用电解法制备
的KOH溶液,生成的产物无污染。以此燃料电池,采用电解法制备 ,装置如图所示。
,装置如图所示。
①石墨Ⅰ电极上的电极反应式为
②Y电极的电极材料是
③通电一段时间后,若右侧玻璃管中产生
 白色沉淀,理论上石墨Ⅱ上通入
白色沉淀,理论上石墨Ⅱ上通入 的体积至少为
的体积至少为
您最近一年使用:0次



