21-22高三上·辽宁沈阳·阶段练习
1 . 双氧水(过氧化氢的水溶液)在工业生产和日常生活中应用广泛。
(1)双氧水的强氧化性使其对大多数病菌和病毒具有消杀功能。用3%医用双氧水对不传染病房喷洒消毒时,地板上有气泡冒出,该气体是__ 。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为__ 。
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为__ ,写出该反应的离子方程式__ 。
(4)如图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式___ 。
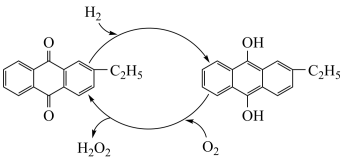
(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir—Ru惰性电极吸附O2生成H2O2,其电极反应式是__ 。
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为__ mol。
(1)双氧水的强氧化性使其对大多数病菌和病毒具有消杀功能。用3%医用双氧水对不传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为
(4)如图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式

(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir—Ru惰性电极吸附O2生成H2O2,其电极反应式是
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为
您最近一年使用:0次
2 . Cu2O是一种重要的工业原料,广泛川作催化剂。
Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为__ 。
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:

阳极的电极反应式为___ 。
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g) CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
(3)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是__ (填字母)。
A.CO的消耗速率等于CH3OH的生成速率
B.一定条件,CO的转化率不再变化
C.在绝热恒容的容器中,反应的平衡常数不再变化
(4)t℃时,在体积为2L固定体积的密闭容器中加入2.00molH2(g)和1.00mol的CO(g)的物质的量随时间的变化如表:
根据表中数据回答:
①氢气平衡转化率为___ 。
②2t℃时该反应的平衡常数为___ 。
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正__ v逆(填“>”“<”或“=”)。
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:__ 。

Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:

阳极的电极反应式为
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g)
 CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1(3)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是A.CO的消耗速率等于CH3OH的生成速率
B.一定条件,CO的转化率不再变化
C.在绝热恒容的容器中,反应的平衡常数不再变化
(4)t℃时,在体积为2L固定体积的密闭容器中加入2.00molH2(g)和1.00mol的CO(g)的物质的量随时间的变化如表:
| 时间(s) | 0 | 2 | 5 | 10 | 20 | 40 | 80 |
| 物质的量(mol) | 1.00 | 0.50 | 0.375 | 0.25 | 0.20 | 0.20 | 0.20 |
①氢气平衡转化率为
②2t℃时该反应的平衡常数为
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:

您最近一年使用:0次
2021-04-19更新
|
503次组卷
|
2卷引用:北京市顺义区2021届高三第二次统练化学试题
3 . 天然气是一种清洁能源,用途广泛。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:_______ 。
②有利于提高混合气中CH4含量的措施是:_______ 。
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。
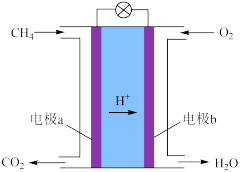
①电极b是_______ 极(填“正”或“负”)。
②a极的电极反应式是_______________ 。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:
②有利于提高混合气中CH4含量的措施是:
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。

①电极b是
②a极的电极反应式是
您最近一年使用:0次
4 . 我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料。
(1)制备碳酸钠。将饱和硫酸钠溶液和饱和碳酸氢铵溶液混合,结晶得NaHCO3晶体,再经加热分解制得碳酸钠。生成NaHCO3晶体的化学方程式是________ 。
已知:I.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol−1
II.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol−1
则:2NaHCO3(s) == Na2CO3(s) + CO2(g) + H2O(g) ΔH=________ kJ·mol−1。
(2)制备烧碱和硫酸。用如图所示装置,以惰性电极进行电解,a、b均为离子交换膜。
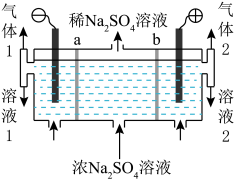
① Na+迁移方向是________ 。
② 气体1是________ ;溶液2是________ 。
(1)制备碳酸钠。将饱和硫酸钠溶液和饱和碳酸氢铵溶液混合,结晶得NaHCO3晶体,再经加热分解制得碳酸钠。生成NaHCO3晶体的化学方程式是
已知:I.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol−1
II.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol−1
则:2NaHCO3(s) == Na2CO3(s) + CO2(g) + H2O(g) ΔH=
(2)制备烧碱和硫酸。用如图所示装置,以惰性电极进行电解,a、b均为离子交换膜。

① Na+迁移方向是
② 气体1是
您最近一年使用:0次
解题方法
5 . 煤的气化技术发展较早,近几年来煤的气化技术更多的倾向于用水煤浆与粉煤为原料的加压气化技术。煤的气化的流程示意图如下:
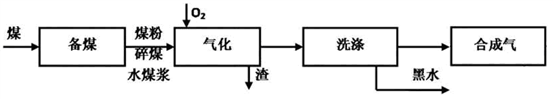
(1)煤的气化过程中,存在如下反应:
① C(s)+O2(g) CO2(g) △H1=-394.1kJ/mol
CO2(g) △H1=-394.1kJ/mol
②2CO(g)+O2(g) 2CO2(g) △H2=-566.0kJ/mol
2CO2(g) △H2=-566.0kJ/mol
③2H2(g)+O2(g) 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol
写出利用水煤浆生产水煤气的热化学方程式___________________ 。
(2)一定条件下,由H2和CO可直接制备二甲醚(CH3OCH3)(产物中还有水蒸气),结果如图所示: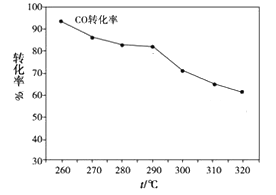
①合成二甲醚的化学方程式为___________________________
②其中CO的转化率随温度的升高而降低的原因_________________ 。
③有利于该反应充分进行的条件是______________ (填字母)
a.高温低压 b.低温高压 c.高温高压 d.低温低压
④在实际生产中选择了适宜温度和压强,原因是考虑了________ 因素
(3)图中,甲装置为CH3OCH3碱性燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
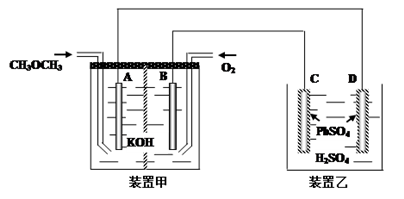
① 写出甲装置中B极的电极反应____________________________
② 写出乙装置中D极的电极反应式___________________________
③ 当有46克二甲醚参加反应时,电路中通过的电子的物质的量为____ mol

(1)煤的气化过程中,存在如下反应:
① C(s)+O2(g)
 CO2(g) △H1=-394.1kJ/mol
CO2(g) △H1=-394.1kJ/mol②2CO(g)+O2(g)
 2CO2(g) △H2=-566.0kJ/mol
2CO2(g) △H2=-566.0kJ/mol③2H2(g)+O2(g)
 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol写出利用水煤浆生产水煤气的热化学方程式
(2)一定条件下,由H2和CO可直接制备二甲醚(CH3OCH3)(产物中还有水蒸气),结果如图所示:

①合成二甲醚的化学方程式为
②其中CO的转化率随温度的升高而降低的原因
③有利于该反应充分进行的条件是
a.高温低压 b.低温高压 c.高温高压 d.低温低压
④在实际生产中选择了适宜温度和压强,原因是考虑了
(3)图中,甲装置为CH3OCH3碱性燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。

① 写出甲装置中B极的电极反应
② 写出乙装置中D极的电极反应式
③ 当有46克二甲醚参加反应时,电路中通过的电子的物质的量为
您最近一年使用:0次



