名校
解题方法
1 . 研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是____________ 。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为___ mol,放出的热量为_______ kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=__________ 。
(4)已知:N2、O2分子中化学键的键能分别是946kJ·mol−1、497kJ·mol−1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol−1。NO分子中化学键的键能为______ 。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+
 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2=
(4)已知:N2、O2分子中化学键的键能分别是946kJ·mol−1、497kJ·mol−1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol−1。NO分子中化学键的键能为
您最近一年使用:0次
2021-06-24更新
|
357次组卷
|
2卷引用:甘肃省静宁县第一中学2020-2021学年高一下学期第三次月考化学(普通班)试题
解题方法
2 . CH4—CO2催化重整是减少温室气体排放的重要途径。已知以下的热化学反应方程式:
C(s)+2H2(g)=CH4(g) △H1=-75kJ/mol
C(s)+O2(g)=CO2(g) △H2=-394kJ/mol
C(s)+ O2(g)=CO(g) △H3=-111kJ/mol
O2(g)=CO(g) △H3=-111kJ/mol
写出催化重整反应CH4(g)和CO2(g)生成CO(g)和H2(g)的热化学方程式:___________ 。
C(s)+2H2(g)=CH4(g) △H1=-75kJ/mol
C(s)+O2(g)=CO2(g) △H2=-394kJ/mol
C(s)+
 O2(g)=CO(g) △H3=-111kJ/mol
O2(g)=CO(g) △H3=-111kJ/mol写出催化重整反应CH4(g)和CO2(g)生成CO(g)和H2(g)的热化学方程式:
您最近一年使用:0次
解题方法
3 . 计算
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=___________ 。
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
下表列出了几种化学键的键能:【CO的结构 】
】
298 K时,上述反应的ΔH=___________ 。
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)下表列出了几种化学键的键能:【CO的结构
 】
】| 化学键 | H-H | C-H | H-O |  |
| 键能kJ/mol | 436 | 413 | 467 | 1072 |
您最近一年使用:0次
4 . 按要求填空:
(1)相对分子质量为72的烷烃的分子式为___________ ,结构有___________ 种,分别写出它们的结构简式___________ 。
(2)下列物质熔沸点由高到低的顺序是:①CH4;②C3H8;③CH3CH(CH3)2 ;④CH3CH2CH2CH3;___________ (填序号)
(3)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出表示甲烷燃烧热的热化学方程式___________ 。
(4)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
②2Al(s)+ O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
Al和FeO发生反应的热化学方程式是___________ 。
(1)相对分子质量为72的烷烃的分子式为
(2)下列物质熔沸点由高到低的顺序是:①CH4;②C3H8;③CH3CH(CH3)2 ;④CH3CH2CH2CH3;
(3)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出表示甲烷燃烧热的热化学方程式
(4)已知:①Fe(s)+
 O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1②2Al(s)+
 O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1Al和FeO发生反应的热化学方程式是
您最近一年使用:0次
名校
解题方法
5 . 请参考题中图表,已知 E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
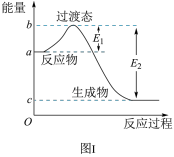
(1)图Ⅰ是 1mol NO2(g)和 1mol CO (g)反应生成 CO2(g)和 NO (g)过程中的能量变化示意图, 若在反应体系中加入催化剂,反应速率增大,E1的变化是______ (填“增大”、“减小”或“不变”, 下同),△H 的变化是 ______ 请写出 NO2和 CO 反应的热化学方程式: ______ 。
(2)将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H = +49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
又知③H2O(g) ═ H2O(l) △H = -44 kJ·mol-1,写出表示甲醇蒸 汽燃烧热的热化学方程式为:______ 。

(1)图Ⅰ是 1mol NO2(g)和 1mol CO (g)反应生成 CO2(g)和 NO (g)过程中的能量变化示意图, 若在反应体系中加入催化剂,反应速率增大,E1的变化是
(2)将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H = +49.0 kJ·mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1又知③H2O(g) ═ H2O(l) △H = -44 kJ·mol-1,写出表示甲醇蒸 汽燃烧热的热化学方程式为:
您最近一年使用:0次
2020-08-06更新
|
172次组卷
|
4卷引用:吉林省“BEST合作体”2020-2021学年高一下学期期中化学试题
名校
6 . 键能的大小可用于计算化学反应的反应热(△H)。
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g) = 2HCl(g)过程中,当生成1molHCl气体时需要___ (填“吸收”或“放出” )____ kJ能量。
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是___ kJ·mol-1。
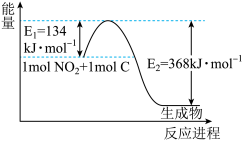
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:____ 。
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=_______ (用含ΔH1、ΔH2、ΔH3的式子表示)。
| 化学键 | Cl-Cl | H—H | H—Cl | N≡N |
| 键能/kJ·mol-1 | 243 | 436 | 431 | 946 |
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g) = 2HCl(g)过程中,当生成1molHCl气体时需要
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=
您最近一年使用:0次
2019-05-07更新
|
279次组卷
|
2卷引用:内蒙古鄂尔多斯市第一中学2020-2021学年高一下学期第三次月考化学试题



