名校
解题方法
1 . CO2和H2一定条件下可以合成甲醇,该过程存在副反应二
反应一:
反应二:
(1)已知25℃和101kPa下,H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1,
H2O(1)=H2O(g)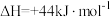 ,
,
则ΔH2=___________ kJ/mol。
(2)工业上可用CO2来制甲醇。
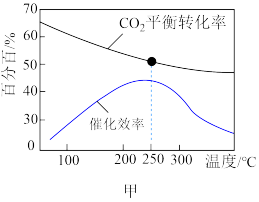
①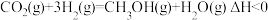 。根据图甲分析,实际工业生产中,反应温度选择250℃的理由是
。根据图甲分析,实际工业生产中,反应温度选择250℃的理由是___________ 。
②利用光电催化原理,由CO2和H2O制备CH3OH的装置如图乙。写出右侧的电极反应式:___________

(3)在恒容密闭容器内,充入1molCO2和3molH2,测得平衡时CO2转化率,CO和CH3OH选择性随温度变化如图所示【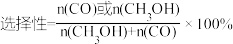 】。250℃下达平衡时,n(H2O)=
】。250℃下达平衡时,n(H2O)=___________ mol,其他条件不变,210℃比230℃平衡时生成的CH3OH___________ (填“多”或“少”)。

(4)在某密闭容器中充入n(CO2):n(H2)=5:17的混合气体,于5.0MPa和催化剂作用下发生反应,平衡时CO和CH3OH在含碳产物中物质的量百分数及CO2的转化率随温度的变化如图所示。
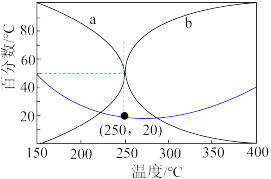
①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是___________ (填“a”或“b”)。
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是___________ 。
反应一:

反应二:

(1)已知25℃和101kPa下,H2(g)、CO(g)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1,
H2O(1)=H2O(g)
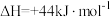 ,
,则ΔH2=
(2)工业上可用CO2来制甲醇。
①
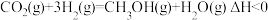 。根据图甲分析,实际工业生产中,反应温度选择250℃的理由是
。根据图甲分析,实际工业生产中,反应温度选择250℃的理由是
②利用光电催化原理,由CO2和H2O制备CH3OH的装置如图乙。写出右侧的电极反应式:

(3)在恒容密闭容器内,充入1molCO2和3molH2,测得平衡时CO2转化率,CO和CH3OH选择性随温度变化如图所示【
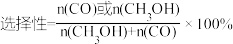 】。250℃下达平衡时,n(H2O)=
】。250℃下达平衡时,n(H2O)=
(4)在某密闭容器中充入n(CO2):n(H2)=5:17的混合气体,于5.0MPa和催化剂作用下发生反应,平衡时CO和CH3OH在含碳产物中物质的量百分数及CO2的转化率随温度的变化如图所示。

①表示平衡时CH3OH在含碳产物中物质的量百分数的曲线是
②CO2平衡转化率随温度的升高先减小后增大,增大的原因可能是
您最近一年使用:0次
2 . 2023年1月,重庆市经济和信息化委员会、重庆市发展和改革委员会、重庆市生态环境局联合印发了《重庆市工业领域碳达峰实施方案》,提出了21项重点工作举措,为实现碳达峰奠定了坚实基础。由 制备甲醇、甲醛、甲酸等,实现
制备甲醇、甲醛、甲酸等,实现 的资源化利用已成为重要课题。回答下列问题:
的资源化利用已成为重要课题。回答下列问题:
(1)常温常压下,甲醛为气态,而甲酸为液态,其原因是___________ 。
(2)科研团队通过多种途径实现了 合成甲醛,总反应为
合成甲醛,总反应为

已知:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

反应Ⅳ: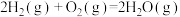

①
___________ 。
②向一恒温恒容容器中充入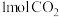 和
和 只发生反应Ⅰ,若起始时容器内压强为1.2kPa,反应经3min达到平衡,平衡时
只发生反应Ⅰ,若起始时容器内压强为1.2kPa,反应经3min达到平衡,平衡时 的分压为0.24kPa,则这段时间内的平均反应速率
的分压为0.24kPa,则这段时间内的平均反应速率
___________ kPa/min。平衡后,再向容器内通入 和
和 ,使二者分压均增大0.05kPa,
,使二者分压均增大0.05kPa, 的转化率将
的转化率将___________ (填“增大”“减小”或“不变”)。
③若在某恒温恒容容器中充入 和
和 只发生反应Ⅱ,下列说法正确的是
只发生反应Ⅱ,下列说法正确的是___________ (填序号)。
A.反应Ⅱ在高温下可以自发进行
B.若混合气体的平均密度不再改变,说明反应Ⅱ已经达到平衡
C.反应任意时刻均存在
D.增大 浓度,
浓度,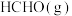 的平衡物质的量分数一定增大
的平衡物质的量分数一定增大
(3)我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s-SnLi用于 制备甲酸。在不使用催化剂和使用s-SnLi催化剂两种反应路径下由
制备甲酸。在不使用催化剂和使用s-SnLi催化剂两种反应路径下由 制备甲酸,各反应物、中间体、产物(其中CO为副产物)的相对能量如图甲所示,据图分析,便用s-SnLi化剂除了能加快制备甲酸反应的速率,还具有的作用是
制备甲酸,各反应物、中间体、产物(其中CO为副产物)的相对能量如图甲所示,据图分析,便用s-SnLi化剂除了能加快制备甲酸反应的速率,还具有的作用是___________ 。


(4)基于催化剂s-SnLi的 电催化制备甲酸盐同时释放电能的装置如图乙所示,该电池放电时,正极的电极方程式为
电催化制备甲酸盐同时释放电能的装置如图乙所示,该电池放电时,正极的电极方程式为___________ 。若电池工作tmin,维持电流强度为IA,理论上消耗 的质量为
的质量为___________ (已知1mol电子所带电荷量为FC,用含I、t、F的代数式表示)。
 制备甲醇、甲醛、甲酸等,实现
制备甲醇、甲醛、甲酸等,实现 的资源化利用已成为重要课题。回答下列问题:
的资源化利用已成为重要课题。回答下列问题:(1)常温常压下,甲醛为气态,而甲酸为液态,其原因是
(2)科研团队通过多种途径实现了
 合成甲醛,总反应为
合成甲醛,总反应为

已知:
反应Ⅰ:


反应Ⅱ:


反应Ⅲ:


反应Ⅳ:
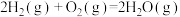

①

②向一恒温恒容容器中充入
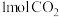 和
和 只发生反应Ⅰ,若起始时容器内压强为1.2kPa,反应经3min达到平衡,平衡时
只发生反应Ⅰ,若起始时容器内压强为1.2kPa,反应经3min达到平衡,平衡时 的分压为0.24kPa,则这段时间内的平均反应速率
的分压为0.24kPa,则这段时间内的平均反应速率
 和
和 ,使二者分压均增大0.05kPa,
,使二者分压均增大0.05kPa, 的转化率将
的转化率将③若在某恒温恒容容器中充入
 和
和 只发生反应Ⅱ,下列说法正确的是
只发生反应Ⅱ,下列说法正确的是A.反应Ⅱ在高温下可以自发进行
B.若混合气体的平均密度不再改变,说明反应Ⅱ已经达到平衡
C.反应任意时刻均存在

D.增大
 浓度,
浓度,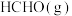 的平衡物质的量分数一定增大
的平衡物质的量分数一定增大(3)我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂s-SnLi用于
 制备甲酸。在不使用催化剂和使用s-SnLi催化剂两种反应路径下由
制备甲酸。在不使用催化剂和使用s-SnLi催化剂两种反应路径下由 制备甲酸,各反应物、中间体、产物(其中CO为副产物)的相对能量如图甲所示,据图分析,便用s-SnLi化剂除了能加快制备甲酸反应的速率,还具有的作用是
制备甲酸,各反应物、中间体、产物(其中CO为副产物)的相对能量如图甲所示,据图分析,便用s-SnLi化剂除了能加快制备甲酸反应的速率,还具有的作用是

(4)基于催化剂s-SnLi的
 电催化制备甲酸盐同时释放电能的装置如图乙所示,该电池放电时,正极的电极方程式为
电催化制备甲酸盐同时释放电能的装置如图乙所示,该电池放电时,正极的电极方程式为 的质量为
的质量为
您最近一年使用:0次
2023-05-14更新
|
168次组卷
|
2卷引用:重庆市第八中学校2023届高三下学期适应性月考(八)化学试题
名校
解题方法
3 . 新型材料 和
和 应用前景广泛,对其制备过程的研究成为热点。回答下列问题:
应用前景广泛,对其制备过程的研究成为热点。回答下列问题:
(1)在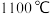 下用镓与氨气制得氮化镓,该可逆反应每生成
下用镓与氨气制得氮化镓,该可逆反应每生成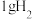 放出
放出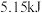 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是_______ (已知金属镓的熔点是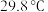 ,沸点是
,沸点是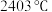 ;氮化镓的熔点为
;氮化镓的熔点为 )。
)。
(2)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中 的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中
的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中 和
和 的温度均小于
的温度均小于 )。
)。
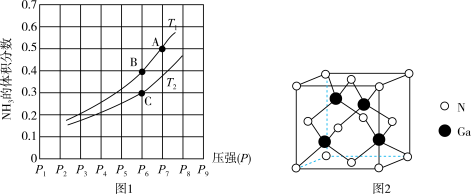
①下列说法错误的是_______ (填标号)。
a.当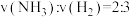 时达到了化学平衡状态
时达到了化学平衡状态
b.温度一定时,达到平衡后再充入氦气(氦气不参与反应), 的转化率减小
的转化率减小
c.B点和C点化学平衡常数的关系是: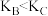
d. 的晶体结构如图2所示,
的晶体结构如图2所示, 原子和N原子都是
原子和N原子都是 杂化
杂化
②已知在 时体系的初始压强为
时体系的初始压强为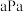 ,则A点的
,则A点的
_______ 。[气相平衡中用组分的平衡分压代替物质的量浓度表示平衡常数(记作 ),分压=总压×气体的物质的量分数,用含a的式子表示]。
),分压=总压×气体的物质的量分数,用含a的式子表示]。
(3)电解精炼法提纯镓的过程中需控制合适的电压,若电压太高时阴极会产生 ,导致电解效率下降。若外电路通过
,导致电解效率下降。若外电路通过 电子时,阴极得到
电子时,阴极得到 的镓。则该电解装置的电解效率
的镓。则该电解装置的电解效率
_______ (已知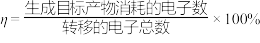 )。
)。
(4)铝粉与 在一定温度下可直接生成
在一定温度下可直接生成 ,加入少量
,加入少量 固体可促进反应。将等质量的铅粉与不同量的
固体可促进反应。将等质量的铅粉与不同量的 混合均匀后置于充满
混合均匀后置于充满 的密闭容器中,用电火花引燃。不同温度下合成产物的
的密闭容器中,用电火花引燃。不同温度下合成产物的 图谱如图3所示,产品中
图谱如图3所示,产品中 的质量分数
的质量分数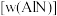 随原料中
随原料中 的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:
的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:

①合成 的最佳条件是
的最佳条件是_______ 。
②当 较小时,有利于
较小时,有利于 制备的原因可能是
制备的原因可能是_______ ;当 超过一定值后,
超过一定值后,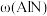 明显减少的原因可能是
明显减少的原因可能是_______ 。
 和
和 应用前景广泛,对其制备过程的研究成为热点。回答下列问题:
应用前景广泛,对其制备过程的研究成为热点。回答下列问题:(1)在
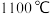 下用镓与氨气制得氮化镓,该可逆反应每生成
下用镓与氨气制得氮化镓,该可逆反应每生成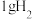 放出
放出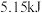 热量。该反应的热化学方程式是
热量。该反应的热化学方程式是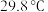 ,沸点是
,沸点是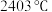 ;氮化镓的熔点为
;氮化镓的熔点为 )。
)。(2)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中
 的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中
的体积分数与压强(P)、温度(T)的关系如图1所示(已知图中 和
和 的温度均小于
的温度均小于 )。
)。
①下列说法错误的是
a.当
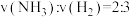 时达到了化学平衡状态
时达到了化学平衡状态b.温度一定时,达到平衡后再充入氦气(氦气不参与反应),
 的转化率减小
的转化率减小c.B点和C点化学平衡常数的关系是:
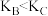
d.
 的晶体结构如图2所示,
的晶体结构如图2所示, 原子和N原子都是
原子和N原子都是 杂化
杂化②已知在
 时体系的初始压强为
时体系的初始压强为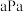 ,则A点的
,则A点的
 ),分压=总压×气体的物质的量分数,用含a的式子表示]。
),分压=总压×气体的物质的量分数,用含a的式子表示]。(3)电解精炼法提纯镓的过程中需控制合适的电压,若电压太高时阴极会产生
 ,导致电解效率下降。若外电路通过
,导致电解效率下降。若外电路通过 电子时,阴极得到
电子时,阴极得到 的镓。则该电解装置的电解效率
的镓。则该电解装置的电解效率
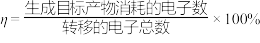 )。
)。(4)铝粉与
 在一定温度下可直接生成
在一定温度下可直接生成 ,加入少量
,加入少量 固体可促进反应。将等质量的铅粉与不同量的
固体可促进反应。将等质量的铅粉与不同量的 混合均匀后置于充满
混合均匀后置于充满 的密闭容器中,用电火花引燃。不同温度下合成产物的
的密闭容器中,用电火花引燃。不同温度下合成产物的 图谱如图3所示,产品中
图谱如图3所示,产品中 的质量分数
的质量分数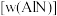 随原料中
随原料中 的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:
的变化如图4所示,燃烧过程中温度随时间的变化如图5所示。则:
①合成
 的最佳条件是
的最佳条件是②当
 较小时,有利于
较小时,有利于 制备的原因可能是
制备的原因可能是 超过一定值后,
超过一定值后,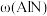 明显减少的原因可能是
明显减少的原因可能是
您最近一年使用:0次
2022-05-04更新
|
455次组卷
|
2卷引用:河南省周口恒大中学2023-2024学年高三上学期12月月考化学试题
4 . 我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳
中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。异丁烯[CH2=C(CH3)2]作为汽油添加剂的主要成分,可利用异丁烷与CO2反应来制备。
反应I:CH3CH(CH3)CH3(g)+CO2(g) CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1
CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1
反应II:CH3CH(CH3)CH3(g) CH2=C(CH3)2(g)+H2(g) △H2
CH2=C(CH3)2(g)+H2(g) △H2
回答下列问题:
(1)已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=
CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=_______ 。
(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为,v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、K逆为速率常数。
①图中能够代表k逆的曲线为_______ (填“L1”“L2”“L3”或“L4”)。
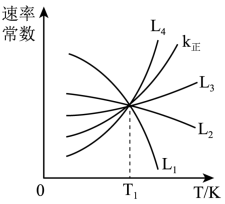
②温度为T1时,该反应的化学平衡常数K=_______ ,平衡时,CH3CH(CH3)CH3的转化率_______ 50%(填“以>”、“=”、“<”)。
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
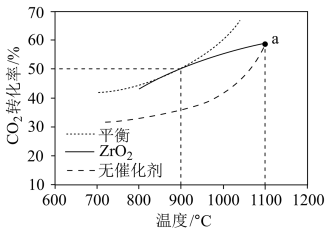
①a点CO2转化率相等的原因是_______ 。
②在pMPa、900°C、ZrO2催化条件下,将CO2、CH4、H2O按物质的量之比为1:1:n充入密闭容器,CO2的平衡转化率为α,此时平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数;写出含α、n、p的计算表达式)。
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:_______ 。
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是_______ ,标准状况下,当阳极生成O2的体积为224mL时,测得阴极区内的c(HCOO-)=0.015mol/L,则电解效率_______ 。(忽略电解前后溶液体积的变化)已知:电解效率=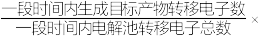 100%。
100%。
中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。异丁烯[CH2=C(CH3)2]作为汽油添加剂的主要成分,可利用异丁烷与CO2反应来制备。
反应I:CH3CH(CH3)CH3(g)+CO2(g)
 CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1
CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1反应II:CH3CH(CH3)CH3(g)
 CH2=C(CH3)2(g)+H2(g) △H2
CH2=C(CH3)2(g)+H2(g) △H2回答下列问题:
(1)已知:CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=
CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为,v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、K逆为速率常数。
①图中能够代表k逆的曲线为

②温度为T1时,该反应的化学平衡常数K=
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
①a点CO2转化率相等的原因是
②在pMPa、900°C、ZrO2催化条件下,将CO2、CH4、H2O按物质的量之比为1:1:n充入密闭容器,CO2的平衡转化率为α,此时平衡常数Kp=
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是
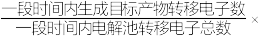 100%。
100%。
您最近一年使用:0次
2022-08-19更新
|
354次组卷
|
2卷引用:重庆缙云教育联盟2023届高三二模考试化学试题



