1 . 利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
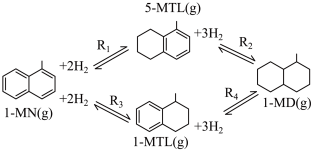
回答下列问题:
(1)1-甲基萘(1-MN)的组成元素电负性由小到大的顺序为___________ 。
(2)已知一定条件下反应 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为___________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)四个平衡体系的平衡常数与温度的关系如图甲所示。
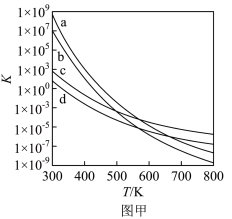
①c、d分别为反应 和
和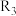 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为___________ 。
②已知反应 的速率方程
的速率方程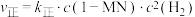 ,
,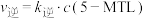 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时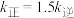 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③下列说法不正确的是___________ (填标号)。
A.四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成四氢萘类物质
D.由上述信息可知,400K时反应 速率最快
速率最快
(4)1-MN在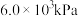 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性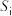 (某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数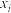 (
(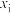 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
___________  (列出计算式)。
(列出计算式)。

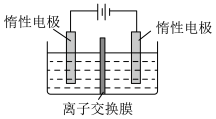
(5)利用膜电解技术(装置如图所示),以 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: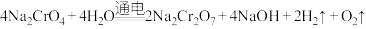 。则
。则 在
在___________ (填“阴”或“阳”)极室制得,电解时通过膜的离子主要为___________ 。

回答下列问题:
(1)1-甲基萘(1-MN)的组成元素电负性由小到大的顺序为
(2)已知一定条件下反应
 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为 、
、 、
、 的代数式表示)。
的代数式表示)。(3)四个平衡体系的平衡常数与温度的关系如图甲所示。

①c、d分别为反应
 和
和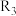 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为②已知反应
 的速率方程
的速率方程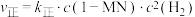 ,
,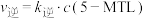 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时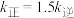 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③下列说法不正确的是
A.四个反应均为放热反应
B.反应体系中1-MD最稳定
C.压强越大,温度越低越有利于生成四氢萘类物质
D.由上述信息可知,400K时反应
 速率最快
速率最快(4)1-MN在
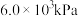 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性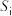 (某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗1-MN的物质的量之比)和物质的量分数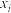 (
(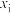 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
 (列出计算式)。
(列出计算式)。
(5)利用膜电解技术(装置如图所示),以
 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: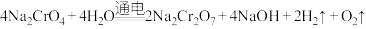 。则
。则 在
在
您最近一年使用:0次
解题方法
2 . 甲烷是一种清洁、高效的能源。煤经过气化、变换、净化得到合成气(含有H2和CO等)的甲烷化技术是当前研究的热点。涉及的反应如下:
反应I:CO(g)+ 3H2(g)⇌CH4(g) + H2O ΔH1 = - 206 kJ/mol
反应II: CO(g) + H2O(g)⇌CO2(g) + H2(g) ΔH2= -41 kJ/mol
反应III: CO2(g)+ 4H2(g)⇌CH4(g) + 2H2O(g) ΔH3
(1)△H3=_______ kJ/mol。反应I在什么温度下能自发进行_______ 。 (填 “高温”或“低温”)
(2)在某密闭容器中通入一定量的CO和H2,加入金属镍做催化剂,在一定温度下发生上述反应。
①为提高CO和H2的平衡转化率,除改变温度外,还可以采取哪些措施_______ 。
②恒温恒容条件下,起始时CO和H2的浓度分别为a mol·L-1和b mol·L-1,达平衡时CH4和CO2的浓度分别为c mol/L和d mol/L。
i.达平衡时,H2O的浓度是_______ mol·L-1。
ii.反应I的平衡常数K是_______ 。 (用a、 b、c、d表示)
(3)Schested认为,以单一负载型 Ni催化反应I时,在催化剂表面存在两种活性中心,分别以“●”和“#”表示,在活性位“●”上发生CO吸附,在活性位“#”上被吸附的CO发生分解反应生成表面碳,表面碳再与H2结合生成CH4,其催化反应机理的反应式如下:
(i)CO+●⇌CO● 快速平衡
(ii)CO●+#⇌O● +C# 慢反应
(iii)C#+ 2H2⇌CH4+# 快反应
(iV)_______ 快反应
写出反应(iV)的反应式_______ ;反应I的决速步骤是哪一步_______ 。
(4)一种利用电化学方法生产甲烷的装置如图所示:
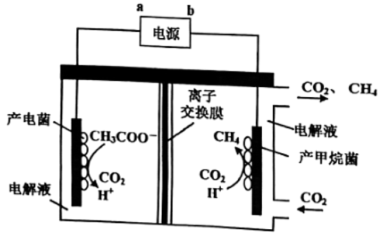
①写出阳极的电极反应式_______ 。
②理论上每生成0.1 mol CH4,阳极室生成CO2的体积是_______ 升。 (标准状况下)
反应I:CO(g)+ 3H2(g)⇌CH4(g) + H2O ΔH1 = - 206 kJ/mol
反应II: CO(g) + H2O(g)⇌CO2(g) + H2(g) ΔH2= -41 kJ/mol
反应III: CO2(g)+ 4H2(g)⇌CH4(g) + 2H2O(g) ΔH3
(1)△H3=
(2)在某密闭容器中通入一定量的CO和H2,加入金属镍做催化剂,在一定温度下发生上述反应。
①为提高CO和H2的平衡转化率,除改变温度外,还可以采取哪些措施
②恒温恒容条件下,起始时CO和H2的浓度分别为a mol·L-1和b mol·L-1,达平衡时CH4和CO2的浓度分别为c mol/L和d mol/L。
i.达平衡时,H2O的浓度是
ii.反应I的平衡常数K是
(3)Schested认为,以单一负载型 Ni催化反应I时,在催化剂表面存在两种活性中心,分别以“●”和“#”表示,在活性位“●”上发生CO吸附,在活性位“#”上被吸附的CO发生分解反应生成表面碳,表面碳再与H2结合生成CH4,其催化反应机理的反应式如下:
(i)CO+●⇌CO● 快速平衡
(ii)CO●+#⇌O● +C# 慢反应
(iii)C#+ 2H2⇌CH4+# 快反应
(iV)_______ 快反应
写出反应(iV)的反应式
(4)一种利用电化学方法生产甲烷的装置如图所示:

①写出阳极的电极反应式
②理论上每生成0.1 mol CH4,阳极室生成CO2的体积是
您最近一年使用:0次



