名校
解题方法
1 . 2024年上海国际碳中和技术博览会以“中和科技、碳素未来”为主题,重点聚焦二氧化碳的捕捉、利用与封存(CCUS)等问题。回答下列问题:
Ⅰ. 是典型的温室气体,Sabatier反应可实现
是典型的温室气体,Sabatier反应可实现 转化为甲烷,实现
转化为甲烷,实现 的资源化利用。合成
的资源化利用。合成 过程中涉及如下反应:
过程中涉及如下反应:
甲烷化反应(主反应):①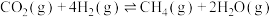

逆变换反应(副反应):②

(1)反应③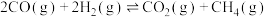

___________ ,该反应在___________ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)下列叙述中能说明反应①达到平衡状态的是___________ (填字母)。
A.断裂4mol 的同时断裂1mol
的同时断裂1mol 
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.
E.绝热恒容条件下, 不再变化
不再变化
(3)科研小组按 进行投料,下面探究影响
进行投料,下面探究影响 选择性的一些因素。
选择性的一些因素。
①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是___________ (填“曲线1”“曲线2”或“曲线3”)。曲线1和曲线3交叉点处 的平衡分压为
的平衡分压为___________ MPa(该空忽略副反应逆变换反应)。
反应a:

反应b: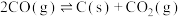

反应c: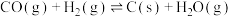

由表中数据可知,积碳反应主要由反应___________ 引起(填“a”“b”或“c”)。
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol 和6mol
和6mol  ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
___________ 。(该反应标准平衡常数的表达式为 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,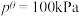 )
)
Ⅰ.
 是典型的温室气体,Sabatier反应可实现
是典型的温室气体,Sabatier反应可实现 转化为甲烷,实现
转化为甲烷,实现 的资源化利用。合成
的资源化利用。合成 过程中涉及如下反应:
过程中涉及如下反应:甲烷化反应(主反应):①
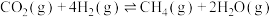

逆变换反应(副反应):②


(1)反应③
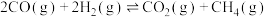

(2)下列叙述中能说明反应①达到平衡状态的是
A.断裂4mol
 的同时断裂1mol
的同时断裂1mol 
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.

E.绝热恒容条件下,
 不再变化
不再变化(3)科研小组按
 进行投料,下面探究影响
进行投料,下面探究影响 选择性的一些因素。
选择性的一些因素。①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示
 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是 的平衡分压为
的平衡分压为
| 温度℃ |  |  |  |
| 800 | 21.60 | 0.136 | 0.133 |
| 850 | 33.94 | 0.058 | 0.067 |
| 900 | 51.38 | 0.027 | 0.036 |


反应b:
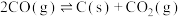

反应c:
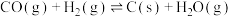

由表中数据可知,积碳反应主要由反应
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol
 和6mol
和6mol  ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,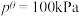 )
)
您最近一年使用:0次
2024-05-27更新
|
198次组卷
|
3卷引用:2024届湖南省岳阳市高三下学期三模化学试题
2 . 主要成分为 的工业废气的回收利用有重要意义。
的工业废气的回收利用有重要意义。
Ⅰ.可利用 热分解制备
热分解制备
(1)已知下列反应的热化学方程式:
①

②

③

计算 热分解反应④
热分解反应④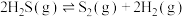
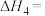
Ⅱ.可利用 与反应制备
与反应制备
(2)根据文献,将
 和
和 的混合气体导入石英管反应器热解,发生反应:
的混合气体导入石英管反应器热解,发生反应:反应Ⅰ:
反应Ⅱ: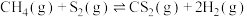
总反应: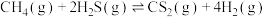
投料按体积之比 ,并用
,并用 稀释;甲烷和硫化氢的混合气体以一定流速通过石英管;常压、不同温度下反应相同时间后,测得和体积分数如下表:
稀释;甲烷和硫化氢的混合气体以一定流速通过石英管;常压、不同温度下反应相同时间后,测得和体积分数如下表:
温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
| 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
| 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
在1000℃、常压下,保持通入 体积分数
体积分数 不变,提高投料比
不变,提高投料比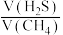 ,
, 的转化率不变,其原因是
的转化率不变,其原因是
(3)实验测定,在950~1150℃范围内(其他条件不变),
 的体积分数随温度升高先增大而后减小,其原因可能是
的体积分数随温度升高先增大而后减小,其原因可能是(4)理论计算表明,在压强为1.1MPa,原料初始组成
 ,只发生反应:
,只发生反应: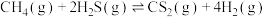 ,达到平衡时四种组分的物质的量分数随温度T的变化如下图所示。
,达到平衡时四种组分的物质的量分数随温度T的变化如下图所示。
①图中表示 、
、 变化的曲线分别是
变化的曲线分别是
②800℃时,反应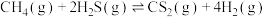 的
的
Ⅲ.可利用间接制备单质硫
(5)先用足量
 溶液吸收
溶液吸收 气体,再将吸收后的溶液用如下图所示的装置电解,碱性条件下,
气体,再将吸收后的溶液用如下图所示的装置电解,碱性条件下, 被氧化生成
被氧化生成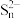 。取阳极区电解后的溶液,加入硫酸可得到单质硫。
。取阳极区电解后的溶液,加入硫酸可得到单质硫。
①图中隔膜应使用
②阳极电极反应式为
您最近一年使用:0次



