名校
1 . 乙醇用途广泛且需求量大,寻求制备乙醇的新方法是研究的热点。
(1) 电催化制备乙醇。电解原理示意图如图1所示。
电催化制备乙醇。电解原理示意图如图1所示。
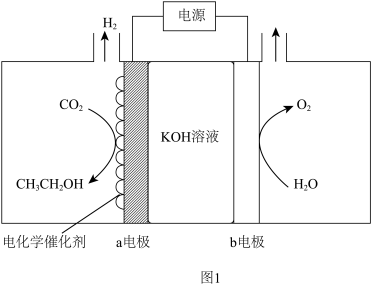
①a电极的电极反应式为_______ 。
②有效抑制a电极发生析氢反应的措施有_______ 。
(2) 催化加氢制备乙醇。
催化加氢制备乙醇。 在催化剂
在催化剂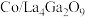 表面加氢制备乙醇的反应为
表面加氢制备乙醇的反应为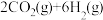

 ,反应机理如图2所示。
,反应机理如图2所示。
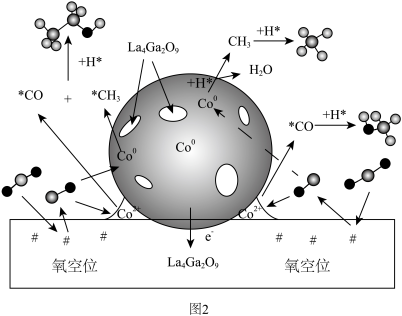
① 在
在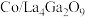 催化剂表面加氢生成
催化剂表面加氢生成 的过程可描述为
的过程可描述为_______ 。
②制取 的过程中可获得的副产物有
的过程中可获得的副产物有_______ 。
③随着反应进行,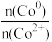 的值
的值_______ (填“增大”、“减小”或“不变”)。
④将 的混合气体置于密闭容器中,在
的混合气体置于密闭容器中,在 和不同温度下反应达到平衡时,
和不同温度下反应达到平衡时, 的转化率和
的转化率和 的选择性[
的选择性[ 的选择性
的选择性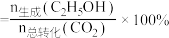 ]如图3所示。温度在时
]如图3所示。温度在时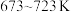 ,CO2的平衡转化率几乎不变,其原因可能为
,CO2的平衡转化率几乎不变,其原因可能为_______ 。
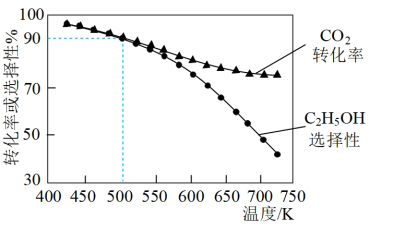
图3
(1)
 电催化制备乙醇。电解原理示意图如图1所示。
电催化制备乙醇。电解原理示意图如图1所示。
①a电极的电极反应式为
②有效抑制a电极发生析氢反应的措施有
(2)
 催化加氢制备乙醇。
催化加氢制备乙醇。 在催化剂
在催化剂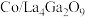 表面加氢制备乙醇的反应为
表面加氢制备乙醇的反应为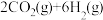

 ,反应机理如图2所示。
,反应机理如图2所示。
①
 在
在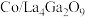 催化剂表面加氢生成
催化剂表面加氢生成 的过程可描述为
的过程可描述为②制取
 的过程中可获得的副产物有
的过程中可获得的副产物有③随着反应进行,
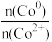 的值
的值④将
 的混合气体置于密闭容器中,在
的混合气体置于密闭容器中,在 和不同温度下反应达到平衡时,
和不同温度下反应达到平衡时, 的转化率和
的转化率和 的选择性[
的选择性[ 的选择性
的选择性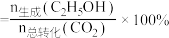 ]如图3所示。温度在时
]如图3所示。温度在时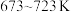 ,CO2的平衡转化率几乎不变,其原因可能为
,CO2的平衡转化率几乎不变,其原因可能为
图3
您最近一年使用:0次
2023-02-15更新
|
584次组卷
|
2卷引用:江苏省无锡市2022-2023学年高三上学期期末调研测试化学试题
2 . 催化剂(Fe,Al)/MIL-53可直接选择性氧化甲烷制甲醇,节省能耗。

(1)(Fe,Al)/MIL-53制备方法如下:Al(NO3)3•9H2O +Al/MIL-53
+Al/MIL-53 (Fe,Al)/MIL-53。
(Fe,Al)/MIL-53。
①对苯二甲酸的结构简式为_______ ,该分子中最多_______ 个原子共平面。
②生成(Fe,Al)/MIL-53过程中溶液pH_______ (填“变大”或“变小”)。
③(Fe,Al)/MIL-53中Fe3+位于O原子形成的_______ 空隙中,1个对苯二甲酸根离子最多能形成_______ 个配位键。
(2)(Fe,Al)/MIL-53催化CH4制CH3OH的机理如图,其中虚线表示吸附状态。

①ii转化为iii的过程中,破坏的微粒间作用力有_______ (填标号)。
A.σ键 B.配位键 C.离子键 D.极性键 E.非极性键
②该催化循环中铁元素价态有_______ 种。
(3)用FeCl3•6H2O和对苯二甲酸合成Fe/MIL-53。两种催化剂在上述催化过程中相对能量的变化情况如图。

①Fe/MIL-53催化过程中决速步骤为_______ (化学键变化角度答题)。
②(Fe,Al)/MIL-53催化效果更佳的原因是_______ 。

(1)(Fe,Al)/MIL-53制备方法如下:Al(NO3)3•9H2O
 +Al/MIL-53
+Al/MIL-53 (Fe,Al)/MIL-53。
(Fe,Al)/MIL-53。①对苯二甲酸的结构简式为
②生成(Fe,Al)/MIL-53过程中溶液pH
③(Fe,Al)/MIL-53中Fe3+位于O原子形成的
(2)(Fe,Al)/MIL-53催化CH4制CH3OH的机理如图,其中虚线表示吸附状态。

①ii转化为iii的过程中,破坏的微粒间作用力有
A.σ键 B.配位键 C.离子键 D.极性键 E.非极性键
②该催化循环中铁元素价态有
(3)用FeCl3•6H2O和对苯二甲酸合成Fe/MIL-53。两种催化剂在上述催化过程中相对能量的变化情况如图。

①Fe/MIL-53催化过程中决速步骤为
②(Fe,Al)/MIL-53催化效果更佳的原因是
您最近一年使用:0次
解题方法
3 . 放热反应在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为_______ 。
(2)甲烷可以消除氮氧化物污染,发生的反应为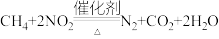 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使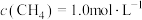 、
、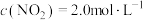 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得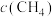 随时间的变化情况如下表:
随时间的变化情况如下表:
①实验1中,在10~20min内,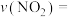
_______ ,40min时v(正)_______ v(逆)(填:“大于”、“小于”、“等于”)。
②0~20min内,实验2比实验1反应速率快的原因可能是_______ 。
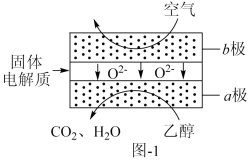
(3)乙醇应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为_______ 。
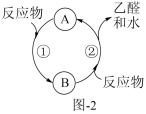
(4)乙醇在Cu作催化剂时与氧气反应的关系如图2,反应②的化学方程式:_______ 。
(5)硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。 高温分解不可能生成
高温分解不可能生成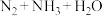 。理由是
。理由是_______ 。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为
(2)甲烷可以消除氮氧化物污染,发生的反应为
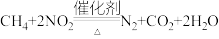 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使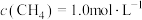 、
、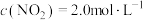 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得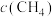 随时间的变化情况如下表:
随时间的变化情况如下表:| 实验 序号 | 时间/min 浓度 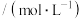 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
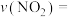
②0~20min内,实验2比实验1反应速率快的原因可能是
(3)乙醇应用于燃料电池,该电池采用可传导
 的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
(4)乙醇在Cu作催化剂时与氧气反应的关系如图2,反应②的化学方程式:

(5)硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。
 高温分解不可能生成
高温分解不可能生成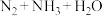 。理由是
。理由是
您最近一年使用:0次
名校
4 . Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
(1)写出大试管中发生反应的化学方程式:_________________ ,该反应是______ 反应(填放热[或吸热)。
(2)实验结果表明,催化剂的催化效果与___________________________ 有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。

(3)该反应的的化学方程式为_____________________________________________ ;
(4)反应开始至2分钟时,B的平均反应速率为_____________________________ 。
(5)能说明该反应已达到平衡状态的是________________________ 。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,当改变下列条件时,反应速率会减小的是____ 。
A.降低温度 B.加入催化剂(正) C.增大容器体积
Ⅲ.为了减缓过量Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你认为可行的是(填编号)________________ 。
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(2)实验结果表明,催化剂的催化效果与
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。

(3)该反应的的化学方程式为
(4)反应开始至2分钟时,B的平均反应速率为
(5)能说明该反应已达到平衡状态的是
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,当改变下列条件时,反应速率会减小的是
A.降低温度 B.加入催化剂(正) C.增大容器体积
Ⅲ.为了减缓过量Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你认为可行的是(填编号)
您最近一年使用:0次
2017-09-16更新
|
334次组卷
|
2卷引用:安徽省定远重点中学2017-2018学年高二上学期期末考试化学试题



