解题方法
1 . 亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:Na2SO3+KIO3+H2SO4=Na2SO4+K2SO4+I2+H2O,该反应过程和机理较复杂,一般认为分为以下几步:
① +
+ →
→ +
+ (慢)
(慢)
② +
+ →IO-+
→IO-+ (快)
(快)
③5I-+6H++ →3I2+3H2O(快)
→3I2+3H2O(快)
④I2+ +H2O→2I-+
+H2O→2I-+ +2H2(快)
+2H2(快)
(1)根据上述条件推测,此反应的总的反应速率由___ 步反应决定。
(2)若预先加入淀粉溶液,由题述看必在___ 离子消耗完时,才会使淀粉变蓝的现象产生。
①
 +
+ →
→ +
+ (慢)
(慢)②
 +
+ →IO-+
→IO-+ (快)
(快)③5I-+6H++
 →3I2+3H2O(快)
→3I2+3H2O(快)④I2+
 +H2O→2I-+
+H2O→2I-+ +2H2(快)
+2H2(快)(1)根据上述条件推测,此反应的总的反应速率由
(2)若预先加入淀粉溶液,由题述看必在
您最近一年使用:0次
10-11高二上·新疆阿勒泰·阶段练习
名校
解题方法
2 . 下列过程中需要加快反应速率的是
| A.钢铁腐蚀 | B.工业炼钢 | C.食物腐烂 | D.塑料老化 |
您最近一年使用:0次
2021-02-08更新
|
121次组卷
|
25卷引用:2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题
(已下线)2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题(已下线)2011-2012年广西北海合浦县教育局教研室高二上学期期中考试化学(理)试卷(已下线)2011-2012年山东济南外国语学校高二下学期期中考试文科化学试卷(已下线)2012-2013学年甘肃永昌一中高二上学期期中考试文科化学试卷(已下线)2013届山东省德州市某中学高三12月月考化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷2014-2015河南省周口中英文学校高一下学期期中考试化学试卷2014-2015学年安徽省淮北师大附属实验中学高一下期中化学试卷2015-2016学年河南省三门峡市陕州中学高二上学期期中测试化学试卷2016-2017学年河北省武邑中学高二上入学考试化学试卷2016-2017学年河北省武邑中学高二上8.28周考化学卷2016-2017学年河北省武邑中学高二上9.21周考化学卷甘肃省武威第十八中学2017-2018学年高二上学期第二次月考化学试题安徽省滁州市定远县西片三校2017-2018学年高二上学期期末考试化学试题【全国百强校】福建省厦门第一中学2017-2018学年高二下学期期中考试化学试题黑龙江省伊春市第二中学2017-2018学年高一下学期期末考试(文)化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题湖南省邵东县创新实验学校2018-2019学年高一下学期期中考试化学试题2016-2017学年上海市闵行区七宝中学高二(上)开学化学试卷福建省福州福清市2017-2018学年高二上学期期中考试化学(理)试题吉林省辽源市田家炳高级中学校2020-2021学年高二上学期期中考试化学试题黑龙江省八校2020-2021学年高二上学期摸底考试化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期期末考试化学试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题
解题方法
3 . 有关O2的研究具有非常重要的意义,2019年3名科学家因发现大多数动物体内O2的感知通路而获得诺贝尔奖。
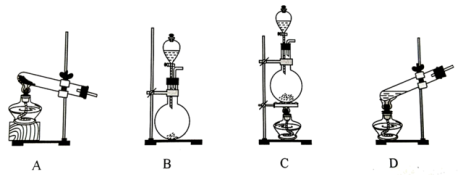
(1)标准状况下,22.4LO2的质量为_______ g。
(2)在MnO2存在下用H2O2为原料制备O2,反应的化学方程式为_________________ , 应选择的气体发生装置为____________ (填字母)。
(3) 已知H2O2不与CI-反应。为探究FeCl3在H2O2制取O2反应中的作用, 某兴趣小组进行下列实验:向试管中加入5mL 11 mol∙L−1H2O2溶液,静置几分钟,无明显现象;滴加2滴1 mol∙L−1FeCl3溶液,立即产生大量气泡。
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5 mol∙L−1,则20min内H2O2的平均反应速率为___ mol∙L−1∙min−1。
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以上实验,可推断出:在H2O2制O2反应中,FeCl3作__________ 剂。
(4)实验完毕,在离开实验室之前,应该完成的事项有________ (写出3项)。

(1)标准状况下,22.4LO2的质量为
(2)在MnO2存在下用H2O2为原料制备O2,反应的化学方程式为
(3) 已知H2O2不与CI-反应。为探究FeCl3在H2O2制取O2反应中的作用, 某兴趣小组进行下列实验:向试管中加入5mL 11 mol∙L−1H2O2溶液,静置几分钟,无明显现象;滴加2滴1 mol∙L−1FeCl3溶液,立即产生大量气泡。
①加FeCl3溶液反应20min后,H2O2的浓度变为10.5 mol∙L−1,则20min内H2O2的平均反应速率为
②反应结束后,滴加KSCN溶液,试管中溶液呈红色。经测定,溶液中Fe3+的量没有变化。综合以上实验,可推断出:在H2O2制O2反应中,FeCl3作
(4)实验完毕,在离开实验室之前,应该完成的事项有
您最近一年使用:0次
2020-12-04更新
|
389次组卷
|
2卷引用:2020年7月广东省普通高中学业水平合格性考试化学试卷
名校
解题方法
4 . 下列人们在生活、生产、实验的相关措施中。不是用来调控化学反应速率的是
| A.将食物存放在温度较低的地方 |
| B.火力发电厂将烟囱建的很高 |
| C.实验时,通常将颗粒状的固体药品研细混匀后进行反应 |
| D.将固体试剂溶于水配成溶液后再进行化学实验 |
您最近一年使用:0次
20-21高二·全国·单元测试
5 . 下列各图所反映的措施中,目的是为了加快其化学反应速率的是
| A | B | C | D |
 |  |  | 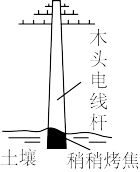 |
| 铁门表面喷漆 | 冰箱保存食物 | 扇子扇煤炉火 | 烤焦电线杆生成焦炭 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
6 . 如图是闪锌矿(主要成分是ZnS,含有少量FeS)制备ZnSO4·7H2O的一种工艺流程:闪锌矿粉→溶浸→除铁→结晶→ZnSO4∙7H2O。已知:相关金属离子浓度为0.1mol/L时形成氢氧化物沉淀的pH范围如表:
(1)闪锌矿在溶浸之前会将其粉碎,其目的是_____________ 。
(2)溶浸过程使用过量的Fe2(SO4)3溶液和H2SO4浸取矿粉,发生的主要反应是:ZnS+2Fe3+=Zn2++2Fe2++S。
①浸出液中含有的阳离子包括Zn2+、Fe2+、_____________ 。
②若改用CuSO4溶液浸取,发生复分解反应,也能达到浸出锌的目的,写出离子方程式_____________ 。
(3)工业除铁过程需要控制沉淀速率,因此分为还原和氧化两步先后进行,如图。还原过程将部分Fe3+转化为Fe2+,得到pH小于1.5的溶液。氧化过程向溶液中先加入氧化物a,再通入O2。下列说法正确的是_____________ (填序号)。
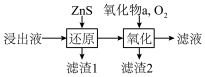
A. 氧化物a可以是ZnO
B. 滤渣2的主要成分是Fe(OH)2
C. 加入ZnS的量和通入O2的速率都可以控制溶液中的c(Fe3+)
| 金属离子 | Fe3+ | Fe2+ | Zn2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 |
(2)溶浸过程使用过量的Fe2(SO4)3溶液和H2SO4浸取矿粉,发生的主要反应是:ZnS+2Fe3+=Zn2++2Fe2++S。
①浸出液中含有的阳离子包括Zn2+、Fe2+、
②若改用CuSO4溶液浸取,发生复分解反应,也能达到浸出锌的目的,写出离子方程式
(3)工业除铁过程需要控制沉淀速率,因此分为还原和氧化两步先后进行,如图。还原过程将部分Fe3+转化为Fe2+,得到pH小于1.5的溶液。氧化过程向溶液中先加入氧化物a,再通入O2。下列说法正确的是

A. 氧化物a可以是ZnO
B. 滤渣2的主要成分是Fe(OH)2
C. 加入ZnS的量和通入O2的速率都可以控制溶液中的c(Fe3+)
您最近一年使用:0次
名校
7 . 下列过程需要加快化学反应速率的是( )
| A.食用油变质 | B.塑料文具盒老化 | C.工业合成氨 | D.钢铁闸门腐蚀 |
您最近一年使用:0次
2020-03-09更新
|
277次组卷
|
2卷引用:2019年12月河北省高中学业水平合格性考试(2018级)化学试题
名校
解题方法
8 . 大气中的部分碘源于O3对海水中I-的氧化。某科学小组进行O3与含I-溶液反应相关研究。
(1)O3将I-氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g) IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HIO(aq) ΔH2
HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
用热化学方程式表示O3氧化I-生成I2的反应___ 。
(2)O3在水中易分解,在一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216mol·L-1。
①在30℃、pH=4.0条件下,O3的分解速率为___ mol·L-1·min-1。
②pH增大能加速O3分解,表明对O3分解起催化作用的是____ 。
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为___ (填字母)。
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
(1)O3将I-氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g)
 IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1②IO-(aq)+H+(aq)
 HIO(aq) ΔH2
HIO(aq) ΔH2③HIO(aq)+I-(aq)+H+(aq)
 I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3用热化学方程式表示O3氧化I-生成I2的反应
(2)O3在水中易分解,在一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216mol·L-1。
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 35 | 15 | 7 |
②pH增大能加速O3分解,表明对O3分解起催化作用的是
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
您最近一年使用:0次
2019-11-15更新
|
102次组卷
|
2卷引用:甘肃省兰州第一中学2019-2020学年高二上学期期中考试化学(理)试题
9 . 某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为____ 。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
①实验①②是探究KIO3浓度对反应速率的影响,表中c=_____ mL;
②实验①③是探究温度对反应速率的影响,表中a=____ 。
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42-对反应起催化作用;
假设二:____ ;
(4)请你设计实验验证上述假设一,完成表中内容。
(1)查阅资料知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3-+3HSO3-=3SO42-+I-+3H+,则第二步反应的离子方程式为
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 12.0 | c | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
②实验①③是探究温度对反应速率的影响,表中a=
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42-对反应起催化作用;
假设二:
(4)请你设计实验验证上述假设一,完成表中内容。
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲)在烧杯乙中先加入少量① | ②若v(甲) ③若v(甲) |
您最近一年使用:0次
名校
10 . (某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=____ ,T1=___ ;通过实验___ 可探究出温度变化对化学反应速率的影响。
(2)C组实验中溶液褪色时间t1____ (填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = ______ 。(用含有t1的式子表示)
(3)写出相应反应的离子方程式_____ 。
| 实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=
(2)C组实验中溶液褪色时间t1
(3)写出相应反应的离子方程式
您最近一年使用:0次
2019-10-11更新
|
128次组卷
|
2卷引用:黑龙江省大庆实验中学2019-2020学年高二上学期第一次月考化学试题



