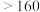解题方法
1 . 镍在工业生产中有重要作用,以粗氧化镍(主要含 、
、 、Fe2O3等)为原料制备纯镍的流程示意图如下:
、Fe2O3等)为原料制备纯镍的流程示意图如下:
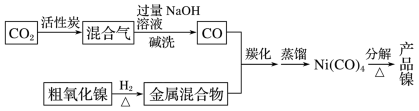
(1)已知C与CO的燃烧热分别为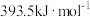 、
、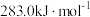 ,则反应
,则反应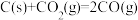
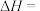
________  。
。
(2)碱洗过程中发生反应的离子方程式为________ 。
(3)羰化反应为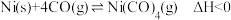 。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
①反应Ⅰ在该温度下的平衡常数K=________ (含x的表达式表示,不考虑单位)。
②下列不能说明反应Ⅲ达到平衡状态的是________ 。
a、平衡常数K不再改变 b.Ni的质量不再改变
c.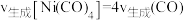 d.容器内的压强不再改变
d.容器内的压强不再改变
③比较平衡时下列物理量的大小:CO的体积分数Ⅰ________ Ⅱ;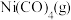 的浓度Ⅰ
的浓度Ⅰ________ Ⅲ(填“>”、“<”或“=”)
(4)羰化后的产物为 、
、 、
、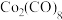 ,有关性质如下表。蒸馏提取
,有关性质如下表。蒸馏提取 应选择的适宜温度范围是
应选择的适宜温度范围是________ 。
(5)采用较高温度下分解 制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:________ 。
 、
、 、Fe2O3等)为原料制备纯镍的流程示意图如下:
、Fe2O3等)为原料制备纯镍的流程示意图如下:
(1)已知C与CO的燃烧热分别为
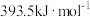 、
、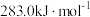 ,则反应
,则反应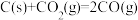
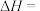
 。
。(2)碱洗过程中发生反应的离子方程式为
(3)羰化反应为
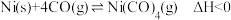 。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:
。在初始温度相同、体积均为1 L的三个密闭容器中分别进行该反应,控制不同条件,反应过程中部分数据见下表:反应时间 |
| CO |
| |
反应Ⅰ:恒温恒容 | 0 min | 足量 | 4 mol | 0 |
| x mol | |||
反应Ⅱ:恒温恒压 | 0 min | 足量 | 4 mol | 0 |
反应Ⅲ:绝热恒容 | 0 min | 0 | 0 | 1 mol |
②下列不能说明反应Ⅲ达到平衡状态的是
a、平衡常数K不再改变 b.Ni的质量不再改变
c.
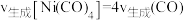 d.容器内的压强不再改变
d.容器内的压强不再改变③比较平衡时下列物理量的大小:CO的体积分数Ⅰ
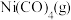 的浓度Ⅰ
的浓度Ⅰ(4)羰化后的产物为
 、
、 、
、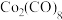 ,有关性质如下表。蒸馏提取
,有关性质如下表。蒸馏提取 应选择的适宜温度范围是
应选择的适宜温度范围是物质 |
|
|
|
沸点/℃ | 106 | 43.2 | 52 |
熔点/℃ |
|
| 31 |
分解温度/℃ |
| 135 | — |
 制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
制取镍。实验证明在一定范围内温度越高,镍中含碳量越高,结合平衡移动原理解释原因:
您最近一年使用:0次
名校
解题方法
2 . 醋酸钠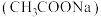 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。
(1)配制 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,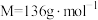 )的质量为
)的质量为_______ 。实验需要的仪器有天平、药匙、玻璃棒、量筒、_______ (从下列图中选择,写出名称)。 水解程度的影响。
水解程度的影响。
甲同学设计实验方案如下(表中溶液浓度均为 ):
):
i.实验_______ 和_______ (填序号),探究加水稀释对 水解程度的影响;
水解程度的影响;
ii.实验1和3,探究加入 对
对 水解程度的影响;
水解程度的影响;
iii.实验1和4,探究温度对 水解程度的影响。
水解程度的影响。
①根据甲同学的实验方案,补充数据:
_______ 。
②实验测得 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据_______ (填一种微粒的化学式)的浓度增大可以说明加入 能促进
能促进 的水解。
的水解。
③已知 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测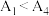 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是_______ 。
(3)小组通过测定不同温度下 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。
查阅资料: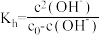 ,
, 为
为 溶液起始浓度。
溶液起始浓度。
试剂: 溶液、
溶液、 盐酸、
盐酸、 计。
计。
实验:测定40℃下 水解常数
水解常数 ,完成下表中序号7的实验。
,完成下表中序号7的实验。
在50℃和60℃下重复上述实验。
数据处理:40℃,
_______ (用含 、
、 、
、 的计算式表示)
的计算式表示)
实验结论: ,温度升高,促进
,温度升高,促进 水解。
水解。
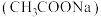 是一种常用的防腐剂和缓冲剂。
是一种常用的防腐剂和缓冲剂。(1)配制
 溶液,需要称量醋酸钠晶体(
溶液,需要称量醋酸钠晶体( ,
,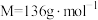 )的质量为
)的质量为
 水解程度的影响。
水解程度的影响。甲同学设计实验方案如下(表中溶液浓度均为
 ):
):i.实验
 水解程度的影响;
水解程度的影响;ii.实验1和3,探究加入
 对
对 水解程度的影响;
水解程度的影响;iii.实验1和4,探究温度对
 水解程度的影响。
水解程度的影响。| 序号 | 温度 | 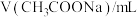 |  | 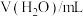 |  |
| 1 | 25℃ | 40.0 | 0 | 0 |  |
| 2 | 25℃ | 4.0 | 0 | 36.0 |  |
| 3 | 25℃ | 20.0 | 10.0 |  |  |
| 4 | 40℃ | 40.0 | 0 | 0 |  |

②实验测得
 ,该结果不足以证明加入
,该结果不足以证明加入 促进了
促进了 的水解。根据
的水解。根据 能促进
能促进 的水解。
的水解。③已知
 水解为吸热反应,甲同学预测
水解为吸热反应,甲同学预测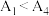 ,但实验结果为
,但实验结果为 。实验结果与预测不一致的原因是
。实验结果与预测不一致的原因是(3)小组通过测定不同温度下
 的水解常数
的水解常数 确定温度对
确定温度对 水解程度的影响。
水解程度的影响。查阅资料:
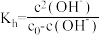 ,
, 为
为 溶液起始浓度。
溶液起始浓度。试剂:
 溶液、
溶液、 盐酸、
盐酸、 计。
计。实验:测定40℃下
 水解常数
水解常数 ,完成下表中序号7的实验。
,完成下表中序号7的实验。| 序号 | 实验 | 记录的数据 |
| 5 | 取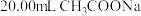 溶液,用 溶液,用 盐酸滴定至终点 盐酸滴定至终点 | 消耗盐酸体积为 |
| 6 | 测40℃纯水的 |  |
| 7 |  |
数据处理:40℃,

 、
、 、
、 的计算式表示)
的计算式表示)实验结论:
 ,温度升高,促进
,温度升高,促进 水解。
水解。
您最近一年使用:0次
2023-03-16更新
|
2406次组卷
|
5卷引用:广东省揭阳华侨高级中学2023-2024学年高三下学期第二次阶段(期中)考试化学试题
广东省揭阳华侨高级中学2023-2024学年高三下学期第二次阶段(期中)考试化学试题广东省广州市2023届高三一模考试化学试题(已下线)专题19 实验综合题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(实验综合题)广东省广州市2022-2023学年高三普通高中毕业班综合测试(一)化学试题