名校
解题方法
1 . 下列实验操作及现象对应的解释正确的是
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向碘水中加入1mLCCl4,振荡,溶液分层,下层CCl4层显紫色,再向试管中加入1mL浓KI溶液,振荡 | CCl4层紫色变浅 | 在水溶液中发生:I2+I-⇌ |
| B | 向酸性KMnO4溶液中通入乙烯气体 | 溶液紫色褪去 | 乙烯发生加成反应 |
| C | 向5mL0.1mol•L-1的CuSO4溶液逐滴加入1mol•L-1的氨水,至出现的蓝色沉淀消失,再加入8mL95%的乙醇溶液,用玻璃棒摩擦试管壁 | 加入乙醇后析出深蓝色晶体 | 乙醇是极性较大的溶剂,导致硫酸四氨合铜晶体析出 |
| D | 点燃某无色气体,将产物通入装有无水CuSO4的U型管中 | 固体变蓝 | 该气体为H2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 一定温度下,在容积为 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示:
2.根据图上信息,从反应开始到第一次达到平衡状态时, 的平均反应速率为
的平均反应速率为___________ 。
3.在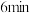 时,可能改变的条件是___________。
时,可能改变的条件是___________。
4.对于该反应,能否通过改变条件使 完全转化为
完全转化为 ?
?___________ (选填“能”或“不能”,原因是___________ 。
 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示: 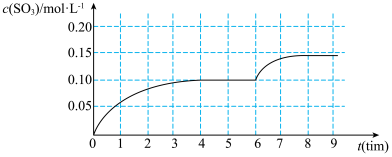
A. | B.压强不变 |
C. 浓度不再发生变化 浓度不再发生变化 | D.密度不变 |
 的平均反应速率为
的平均反应速率为3.在
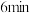 时,可能改变的条件是___________。
时,可能改变的条件是___________。| A.降低温度 | B.增加 浓度 浓度 | C.减小压强 | D.增加 浓度 浓度 |
 完全转化为
完全转化为 ?
?
您最近一年使用:0次
名校
解题方法
3 . 工业上利用黄铁矿(FeS2)制取硫酸,其反应流程如下:

| A.反应①矿石粉碎的目的是提高反应速率 |
| B.反应②中即使通入过量的氧气,也不能将SO2全部转化成SO3 |
| C.接触室选择500℃左右的温度是因为比常温更有利于合成SO3 |
| D.过量的氨水吸收SO2的化学方程式:2NH3·H2O+SO2=(NH4)2SO3+H2O |
您最近一年使用:0次
2024-03-20更新
|
84次组卷
|
2卷引用:广东省惠州一中实验学校2023-2024学年高二上学期期中考试化学试题
4 . 下列对化学平衡移动的分析中,不正确 的是
①已达平衡的反应 ,当仅增加反应物物质的量时,平衡一定向正反应方向移动
,当仅增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应 ,当仅增大
,当仅增大 的浓度时,平衡向正反应方向移动,
的浓度时,平衡向正反应方向移动, 的转化率升高
的转化率升高
③有气体参加的反应达平衡时,仅缩小容器容积,平衡一定向气体总系数增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
①已达平衡的反应
 ,当仅增加反应物物质的量时,平衡一定向正反应方向移动
,当仅增加反应物物质的量时,平衡一定向正反应方向移动②已达平衡的反应
 ,当仅增大
,当仅增大 的浓度时,平衡向正反应方向移动,
的浓度时,平衡向正反应方向移动, 的转化率升高
的转化率升高③有气体参加的反应达平衡时,仅缩小容器容积,平衡一定向气体总系数增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
您最近一年使用:0次
2023-12-09更新
|
196次组卷
|
6卷引用:广东省广州市培英中学2023-2024学年高二上学期期中考试化学试题
广东省广州市培英中学2023-2024学年高二上学期期中考试化学试题北京市昌平区第二中学2023-2024高二上学期期中考试化学试题(已下线)寒假作业03 化学平衡-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)江西省上饶市广丰中学2023-2024学年高二上学期12月考试化学试卷(已下线)专题03 化学平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题
名校
5 . 已知:可逆反应2SO2(g) + O2(g)⇌2SO3(g) △H<0,在一密闭容器中,该反应已达到平衡状态,按要求完成下列内容:
(1)2mol SO2(g) 和 1mol O2(g)的总能量_______ 2mol SO3(g)的总能量(填写“>”、“<”或“=”)
(2)保持容器体积不变,升高温度,平衡_______ 移动(填写“正向”、“逆向”或“不”)
(3)保持温度不变,压缩体积,平衡_______ 移动(填写“正向”、“逆向”或“不”),平衡常数_______ (填写“增大”、“减小”或“不变”)
(4)常温下, 溶液中,
溶液中,
_______ (填“>”“<”或“=”) ;
;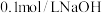 溶液的
溶液的
_______ 。
(5) 溶液呈
溶液呈_______ (填“酸”“碱”或“中”)性,其原因是_______ (用离子方程式表示)。
(1)2mol SO2(g) 和 1mol O2(g)的总能量
(2)保持容器体积不变,升高温度,平衡
(3)保持温度不变,压缩体积,平衡
(4)常温下,
 溶液中,
溶液中,
 ;
;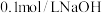 溶液的
溶液的
(5)
 溶液呈
溶液呈
您最近一年使用:0次
名校
6 . 氢能是一种极具发展潜力的清洁能源,下列反应是目前大规模制取氢气的方法之一。CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2kJ/mol,恒温恒容时,下列措施可以同时提高反应速率和H2O的转化率的是
| A.加压 | B.增大一氧化碳的浓度 | C.升温 | D.分离出二氧化碳 |
您最近一年使用:0次
2023-08-25更新
|
167次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
7 . 已知断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B的键能。如表列出了一些化学键的键能(E):
(1)反应H2(g)+ O2(g)=H2O(g)放出241.8kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8kJ能量,则根据所给键能数据可得x=______ 。
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。
CH3OH(g),反应过程中的能量变化情况如图所示。曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。
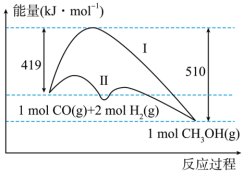
①计算当反应生成1.5molCH3OH(g)时,能量变化值是______ kJ。
②推测反应CH3OH(g) CO(g)+2H2(g)是
CO(g)+2H2(g)是______ (填“吸热”或“放热”)反应。
(3)为发展低碳经济,还有科学家提出可以用氧化锆锌作催化剂,将CO2转化为重要有机原料CH3OH,该反应的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在容积为2L的恒温密闭容器中,充入1molCO2和3molH2,一段时间内CO2和CH3OH的物质的量随时间的变化如表所示。
CH3OH(g)+H2O(g)。在容积为2L的恒温密闭容器中,充入1molCO2和3molH2,一段时间内CO2和CH3OH的物质的量随时间的变化如表所示。
①表中,a为______ mol。
②由表可知,3~6min内,v(CO2)=______ mol•L-1•min-1。
③对于上述反应,下列叙述正确的是______ 。
A.当各气体的浓度不再改变时,该反应一定已达平衡状态
B.当该反应达到平衡后,n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
C.由表可知,3min时CH3OH的生成速率大于12min时CH3OH的分解速率
| 化学键 | H-H | O=O | O-H |
| E/(kJ•mol-1) | 436 | x | 463 |
 O2(g)=H2O(g)放出241.8kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8kJ能量,则根据所给键能数据可得x=(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g),反应过程中的能量变化情况如图所示。曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。
CH3OH(g),反应过程中的能量变化情况如图所示。曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。
①计算当反应生成1.5molCH3OH(g)时,能量变化值是
②推测反应CH3OH(g)
 CO(g)+2H2(g)是
CO(g)+2H2(g)是(3)为发展低碳经济,还有科学家提出可以用氧化锆锌作催化剂,将CO2转化为重要有机原料CH3OH,该反应的化学方程式为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。在容积为2L的恒温密闭容器中,充入1molCO2和3molH2,一段时间内CO2和CH3OH的物质的量随时间的变化如表所示。
CH3OH(g)+H2O(g)。在容积为2L的恒温密闭容器中,充入1molCO2和3molH2,一段时间内CO2和CH3OH的物质的量随时间的变化如表所示。| 时间 | 0min | 3min | 6min | 9min | 12min |
| n(CH3OH) | 0mol | 0.50mol | 0.65mol | 0.75mol | 0.75mol |
| n(CO2) | 1mol | 0.50mol | 0.35mol | a | 0.25mol |
②由表可知,3~6min内,v(CO2)=
③对于上述反应,下列叙述正确的是
A.当各气体的浓度不再改变时,该反应一定已达平衡状态
B.当该反应达到平衡后,n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
C.由表可知,3min时CH3OH的生成速率大于12min时CH3OH的分解速率
您最近一年使用:0次
名校
8 . 合成氨是工业上的重要反应:N2(g)+3H2(g) 2NH3(g),下列说法
2NH3(g),下列说法不正确 的是
 2NH3(g),下列说法
2NH3(g),下列说法| A.增大压强既加快反应速率,又有利于平衡向合成氨方向移动 |
| B.反应达平衡状态后,单位时间内生成1molN2的同时消耗3molH2 |
| C.将氨分离出来,有利于平衡向合成氨方向移动 |
| D.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动 |
您最近一年使用:0次
解题方法
9 . 二氧化碳催化加氢合成乙烯是综合利用 的热点研究领域。相关的主要化学反应有:
的热点研究领域。相关的主要化学反应有:
Ⅰ.

Ⅱ.

Ⅲ.

(1)将 和
和 按物质的量之比为1:3投入一密闭容器中反应。(只考虑反应Ⅰ)
按物质的量之比为1:3投入一密闭容器中反应。(只考虑反应Ⅰ)
①当通入的气体总物质的量一定时,在固定体积、不同温度下,产物乙烯的体积分数随时间的变化如图1所示。试结合图1判断该反应自发进行的条件并说明理由___________ 。

②下列描述正确的是___________ 。
A.升高温度使反应的平衡常数增大
B.加压有助于反应的平衡正向移动
C.恒压时, 可以说明反应达到平衡
可以说明反应达到平衡
D.恒容时,再充入一定量 ,反应平衡体系中
,反应平衡体系中 增大
增大
(2)现将一定量的 和
和 置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应一段时间后测定生成物的浓度,得到图2和图3。
置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应一段时间后测定生成物的浓度,得到图2和图3。
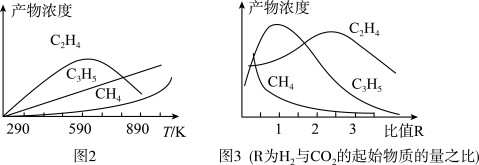
①结合图2和图3,该模拟工业生产制备乙烯的适宜条件为___________ 。
②725K时,将 和
和 的混合气体(体积比为1:3,总物质的量为4mol)在VL的固定容积容器中反应,并在一定催化剂下只进行反应Ⅰ和Ⅲ.达到平衡时,测得容器中
的混合气体(体积比为1:3,总物质的量为4mol)在VL的固定容积容器中反应,并在一定催化剂下只进行反应Ⅰ和Ⅲ.达到平衡时,测得容器中 和
和 的物质的量均为
的物质的量均为 mol,则在该温度下反应Ⅲ的平衡常数K为
mol,则在该温度下反应Ⅲ的平衡常数K为___________ 。
③在一定温度和压强条件下,为了提高反应物气体的转化率,采用了选择性膜技术,可选择性地让某气体通过而离开体系)。当选择性膜吸附乙烯气体时,可以降低副产物 的选择性(
的选择性( 选择性:生成
选择性:生成 消耗的
消耗的 的物质的量与总共转化了的
的物质的量与总共转化了的 的物质的量之比),请结合具体反应说明原因
的物质的量之比),请结合具体反应说明原因___________ 。
 的热点研究领域。相关的主要化学反应有:
的热点研究领域。相关的主要化学反应有:Ⅰ.


Ⅱ.


Ⅲ.


(1)将
 和
和 按物质的量之比为1:3投入一密闭容器中反应。(只考虑反应Ⅰ)
按物质的量之比为1:3投入一密闭容器中反应。(只考虑反应Ⅰ)①当通入的气体总物质的量一定时,在固定体积、不同温度下,产物乙烯的体积分数随时间的变化如图1所示。试结合图1判断该反应自发进行的条件并说明理由

②下列描述正确的是
A.升高温度使反应的平衡常数增大
B.加压有助于反应的平衡正向移动
C.恒压时,
 可以说明反应达到平衡
可以说明反应达到平衡D.恒容时,再充入一定量
 ,反应平衡体系中
,反应平衡体系中 增大
增大(2)现将一定量的
 和
和 置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应一段时间后测定生成物的浓度,得到图2和图3。
置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应一段时间后测定生成物的浓度,得到图2和图3。
①结合图2和图3,该模拟工业生产制备乙烯的适宜条件为
②725K时,将
 和
和 的混合气体(体积比为1:3,总物质的量为4mol)在VL的固定容积容器中反应,并在一定催化剂下只进行反应Ⅰ和Ⅲ.达到平衡时,测得容器中
的混合气体(体积比为1:3,总物质的量为4mol)在VL的固定容积容器中反应,并在一定催化剂下只进行反应Ⅰ和Ⅲ.达到平衡时,测得容器中 和
和 的物质的量均为
的物质的量均为 mol,则在该温度下反应Ⅲ的平衡常数K为
mol,则在该温度下反应Ⅲ的平衡常数K为③在一定温度和压强条件下,为了提高反应物气体的转化率,采用了选择性膜技术,可选择性地让某气体通过而离开体系)。当选择性膜吸附乙烯气体时,可以降低副产物
 的选择性(
的选择性( 选择性:生成
选择性:生成 消耗的
消耗的 的物质的量与总共转化了的
的物质的量与总共转化了的 的物质的量之比),请结合具体反应说明原因
的物质的量之比),请结合具体反应说明原因
您最近一年使用:0次
名校
10 . 甲烷是一种温室气体,将它转化为高附加值产品甲醇具有重要意义。目前工业上的甲烷转化大多需要先通过重整生成合成气(CO、 )再转化为甲醇,涉及的反应如下:
)再转化为甲醇,涉及的反应如下:
反应Ⅰ: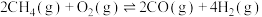

反应Ⅱ:
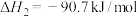
在密闭容器中通入3mol 和2mol
和2mol  ,假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中
,假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中 和
和 的平衡体积分数随温度变化如图所示。
的平衡体积分数随温度变化如图所示。

已知:对于反应Ⅱ, ,
, ,
, 、
、 为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是
为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是
 )再转化为甲醇,涉及的反应如下:
)再转化为甲醇,涉及的反应如下:反应Ⅰ:
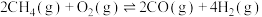

反应Ⅱ:

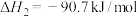
在密闭容器中通入3mol
 和2mol
和2mol  ,假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中
,假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中 和
和 的平衡体积分数随温度变化如图所示。
的平衡体积分数随温度变化如图所示。
已知:对于反应Ⅱ,
 ,
, ,
, 、
、 为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是
为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是A.压强为0.2MPa时,表示 和 和 的曲线分别是b、d 的曲线分别是b、d |
| B.混合气体的平均相对分子质量保持不变时,说明反应体系已达到平衡 |
C.在升温的过程中,反应Ⅱ速率常数增大的倍数; > > |
D.500K,2MPa条件下,若平衡时CO的物质的量为1mol,则 的转化率约为66.7% 的转化率约为66.7% |
您最近一年使用:0次
2023-05-13更新
|
540次组卷
|
4卷引用:辽宁省沈阳市五校协作体2023-2024学年高三上学期期中考试化学试题
辽宁省沈阳市五校协作体2023-2024学年高三上学期期中考试化学试题 重庆市2023届高三下学期5月“三诊”化学试题(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)选择题11-14



