名校
1 . 某化学兴趣小组同学进行如下实验:①分别向 溶液和
溶液和 溶液中滴加KSCN溶液,均无明显现象。②向
溶液中滴加KSCN溶液,均无明显现象。②向 和
和 的混合液中滴加少量KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。已知:CuSCN为白色、难溶性物质;
的混合液中滴加少量KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。已知:CuSCN为白色、难溶性物质; 为无色离子;
为无色离子; 为深蓝色离子。下列说法不正确的是
为深蓝色离子。下列说法不正确的是
 溶液和
溶液和 溶液中滴加KSCN溶液,均无明显现象。②向
溶液中滴加KSCN溶液,均无明显现象。②向 和
和 的混合液中滴加少量KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。已知:CuSCN为白色、难溶性物质;
的混合液中滴加少量KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。已知:CuSCN为白色、难溶性物质; 为无色离子;
为无色离子; 为深蓝色离子。下列说法不正确的是
为深蓝色离子。下列说法不正确的是A.实验①说明 不能与SCN反应生成CuSCN 不能与SCN反应生成CuSCN |
B.实验②中红色褪去的原因是振荡后 降低 降低 |
C.实验③中无色溶液变蓝色的原因是: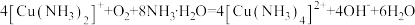 |
D.依据实验①、②、③推测,②中由于生成CuSCN,使 氧化性增强,将 氧化性增强,将 氧化为 氧化为 |
您最近一年使用:0次
名校
2 . 铜、钛、钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的价电子轨道表示式为___________ ,未成对电子数为___________ 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。与 互为等电子体的阳离子的化学式为
互为等电子体的阳离子的化学式为___________ 。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。___________ (填碳原子旁标的序号)。
(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___________ 。根据价电子对互斥理论,预测[Co(NH3)4(H2O)2]2+的立体构型为___________ 体(填相关的立体构型)。
(5)我们通过学习,已经了解到Fe3+溶液在不同溶液中会显示不同的颜色,例如:[Fe(H2O)6]3+溶液显浅紫色(接近无色,肉眼几乎看不见浅紫色);[FeCl4(H2O)2]-溶液显黄色,[Fe(H2O)6-n(OH)n]3-n溶液显黄色。
已知Fe3+溶液存在以下平衡:
[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6-n(OH)n]3-n+nH3O+(正向为Fe3+水解)
[Fe(H2O)6]3++4Cl-⇌[FeCl4(H2O)2]-+4H2O请用上述平衡预测:
若两只盛有等量的Fe(NO3)3固体的试管,向第一只试管加1mL水,向第二只试管加1mL1mol/L稀硝酸,第一只试管发生的现象是___________ ,第二只试管发生的现象是___________ 。
(6)铜与类卤素(SCN)2反应生成Cu(SCN)2,HSCN结构有两种,分别是硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),沸点高的是___________ ,沸点高的原因是:___________ 。
(7)NH4HF2中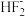 的结构为F-H…F-,则NH4HF2中含有的化学键有
的结构为F-H…F-,则NH4HF2中含有的化学键有___________ (填标号)。
A.氢键 B.价键 C.金属键 D.离子键 E.配位键
(1)钴元素基态原子的价电子轨道表示式为
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。与
 互为等电子体的阳离子的化学式为
互为等电子体的阳离子的化学式为(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。

(4)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为
(5)我们通过学习,已经了解到Fe3+溶液在不同溶液中会显示不同的颜色,例如:[Fe(H2O)6]3+溶液显浅紫色(接近无色,肉眼几乎看不见浅紫色);[FeCl4(H2O)2]-溶液显黄色,[Fe(H2O)6-n(OH)n]3-n溶液显黄色。
已知Fe3+溶液存在以下平衡:
[Fe(H2O)6]3++nH2O⇌[Fe(H2O)6-n(OH)n]3-n+nH3O+(正向为Fe3+水解)
[Fe(H2O)6]3++4Cl-⇌[FeCl4(H2O)2]-+4H2O请用上述平衡预测:
若两只盛有等量的Fe(NO3)3固体的试管,向第一只试管加1mL水,向第二只试管加1mL1mol/L稀硝酸,第一只试管发生的现象是
(6)铜与类卤素(SCN)2反应生成Cu(SCN)2,HSCN结构有两种,分别是硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),沸点高的是
(7)NH4HF2中
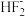 的结构为F-H…F-,则NH4HF2中含有的化学键有
的结构为F-H…F-,则NH4HF2中含有的化学键有A.氢键 B.价键 C.金属键 D.离子键 E.配位键
您最近一年使用:0次
名校
3 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与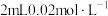 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与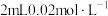 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。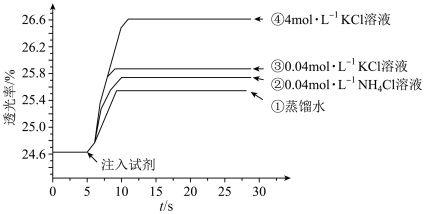
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
362次组卷
|
7卷引用:北京市对外经济贸易大学附属中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
4 . CO2催化加氢可合成二甲醚,发生的主要反应有:
反应Ⅰ: 2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);ΔH1=-122.5 kJ·mol-1
CH3OCH3(g)+3H2O(g);ΔH1=-122.5 kJ·mol-1
反应Ⅱ: CO2(g)+H2(g) CO(g)+H2O(g);ΔH2=a kJ·mol-1
CO(g)+H2O(g);ΔH2=a kJ·mol-1
在恒压、n始(CO2)和n始(H2)=1∶3时,若仅考虑上述反应,平衡时CH3OCH3和CO的选择性及CO2的转化率随温度的变化如图中实线所示。CH3OCH3的选择性=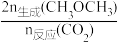 ×100%,下列说法错误的是
×100%,下列说法错误的是
反应Ⅰ: 2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g);ΔH1=-122.5 kJ·mol-1
CH3OCH3(g)+3H2O(g);ΔH1=-122.5 kJ·mol-1反应Ⅱ: CO2(g)+H2(g)
 CO(g)+H2O(g);ΔH2=a kJ·mol-1
CO(g)+H2O(g);ΔH2=a kJ·mol-1在恒压、n始(CO2)和n始(H2)=1∶3时,若仅考虑上述反应,平衡时CH3OCH3和CO的选择性及CO2的转化率随温度的变化如图中实线所示。CH3OCH3的选择性=
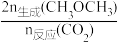 ×100%,下列说法错误的是
×100%,下列说法错误的是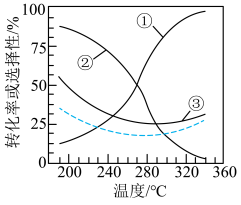
| A.图中曲线③表示平衡时CO2转化率随温度的变化 |
| B.a>0 |
| C.平衡时H2转化率随温度的变化可能如图中虚线所示 |
| D.200 ℃时, 使用对反应Ⅰ选择性高的催化剂可提高CH3OCH3的生产效率 |
您最近一年使用:0次
2023-05-03更新
|
650次组卷
|
5卷引用:江苏省海安高级中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
5 . 苯乙烯是一种重要的有机化工原料,可广泛用于合成橡胶,工程塑料及制药等。工业上可通过乙苯催化脱氢来制取苯乙烯,反应方程式如下:
___________ 。
(2)下列关于该反应的说法不正确的是___________。
(3)工业上通入过热水蒸气 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应
①反应中通入水蒸气的作用是___________
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为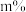 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
___________ (分压 总压
总压 物质的量分数)
物质的量分数)
(4)保持温度为 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应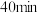 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线___________ 。

 ;
;

| 物质 | 乙苯 | 苯乙烯 | 氢气 |
燃烧热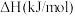 |  |  |  |
| A.高温、低压有利于该反应平衡正向进行 |
| B.高温恒压条件下,乙苯可能会裂解产生积碳覆盖在催化剂的表面,使催化效果下降 |
| C.恒温恒容条件下,反应达到平衡后,向体系中再充入乙苯蒸气,乙苯的转化率将增大 |
| D.选择合适的催化剂可以缩短达到平衡的时间,可使乙苯的平衡转化率变大 |
 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应①反应中通入水蒸气的作用是
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为
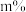 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
 总压
总压 物质的量分数)
物质的量分数)(4)保持温度为
 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应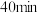 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线
您最近一年使用:0次
2023-04-27更新
|
162次组卷
|
2卷引用:浙江省余姚中学2022-2023学年高二下学期期中考试 化学试题
解题方法
6 . 一种捕获并资源化利用 的方法是将
的方法是将 催化加氢合成
催化加氢合成 ,其过程中主要发生如下反应:
,其过程中主要发生如下反应:
Ⅰ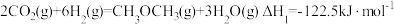
Ⅱ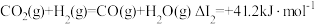
向恒压密闭容器中充入1 mol 和3 mol
和3 mol ,
, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性[
的选择性[ 的选择性
的选择性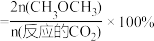 ]随温度的变化如图所示。
]随温度的变化如图所示。
下列说法不正确的是
 的方法是将
的方法是将 催化加氢合成
催化加氢合成 ,其过程中主要发生如下反应:
,其过程中主要发生如下反应:Ⅰ
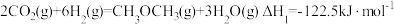
Ⅱ
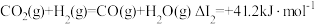
向恒压密闭容器中充入1 mol
 和3 mol
和3 mol ,
, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性[
的选择性[ 的选择性
的选择性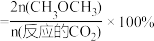 ]随温度的变化如图所示。
]随温度的变化如图所示。下列说法不正确的是
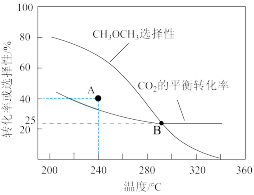
A.增大反应体系压强, 选择性增大 选择性增大 |
B.由图可知,为了提高 的产率,应使用较低温度下的高效催化剂 的产率,应使用较低温度下的高效催化剂 |
C.其他条件不变在240℃时,提高 原料比可使 原料比可使 的平衡转化率达到40% 的平衡转化率达到40% |
D.反应状态达B点时,容器中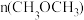 为1/16 mol 为1/16 mol |
您最近一年使用:0次
2023-04-25更新
|
131次组卷
|
2卷引用:江苏省镇江市2022-2023学年高二下学期期中考试化学试题
7 . 氮及其化合物对自然界生物的繁衍起着至关重要的作用。完成下列填空:
(1) 参与的反应条件往往较苛刻,从键能的角度解释原因。
参与的反应条件往往较苛刻,从键能的角度解释原因。_______ 。
(2) 与
与 反应生成
反应生成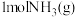 的能量变化如图所示。
的能量变化如图所示。 与
与 制备
制备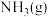 的热化学方程式为
的热化学方程式为_______ 。 中
中 的键能为
的键能为_______
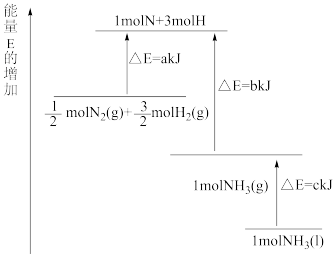
(3)对于合成氨反应,既可以提高平衡体系中 的百分含量,又能加快反应速率的措施是_______。
的百分含量,又能加快反应速率的措施是_______。
尿素 是人类历史上首个由无机物人工合成的有机物。合成尿素的历程一般认为如下两步:
是人类历史上首个由无机物人工合成的有机物。合成尿素的历程一般认为如下两步:
Ⅰ.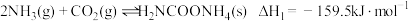
Ⅱ.
(4)如图中能定性表示反应Ⅰ的 ,随温度变化的曲线是
,随温度变化的曲线是_______ (填“A”或“B”)。
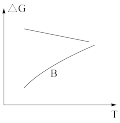
(5)若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是_______。
电解法处理含尿素废水的装置示意图如下图所示。
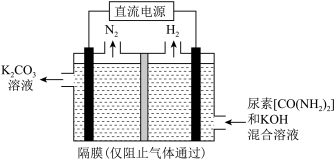
(6)该装置阳极的电极反应式为_______ 。
(7)若废水中尿素的含量为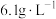 ,处理过的废水中尿素的含量低于
,处理过的废水中尿素的含量低于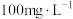 ,若两极共产生气体
,若两极共产生气体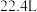 (标准状况下),理论上最多处理废水
(标准状况下),理论上最多处理废水_______ L。
(8) 催化还原法能治理氮氧化物
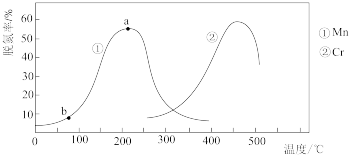
催化还原法能治理氮氧化物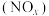 污染。如图所示是一定时间内,在不同温度下分别使用催化剂
污染。如图所示是一定时间内,在不同温度下分别使用催化剂 和
和 时的脱氮率,由此可知工业上使用的最佳催化剂和相应最佳温度分别为
时的脱氮率,由此可知工业上使用的最佳催化剂和相应最佳温度分别为_______ ;使用 作催化剂时,脱氮率b~a段呈现如图所示变化的原因可能是
作催化剂时,脱氮率b~a段呈现如图所示变化的原因可能是_______ 。
(1)
 参与的反应条件往往较苛刻,从键能的角度解释原因。
参与的反应条件往往较苛刻,从键能的角度解释原因。(2)
 与
与 反应生成
反应生成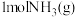 的能量变化如图所示。
的能量变化如图所示。 与
与 制备
制备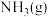 的热化学方程式为
的热化学方程式为 中
中 的键能为
的键能为
(3)对于合成氨反应,既可以提高平衡体系中
 的百分含量,又能加快反应速率的措施是_______。
的百分含量,又能加快反应速率的措施是_______。| A.升高温度 | B.将平衡体系中的氨气分离出来 |
| C.增大体系压强 | D.加入合适的催化剂 |
尿素
 是人类历史上首个由无机物人工合成的有机物。合成尿素的历程一般认为如下两步:
是人类历史上首个由无机物人工合成的有机物。合成尿素的历程一般认为如下两步:Ⅰ.
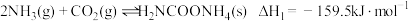
Ⅱ.

(4)如图中能定性表示反应Ⅰ的
 ,随温度变化的曲线是
,随温度变化的曲线是
(5)若反应Ⅱ为慢反应,下列示意图中能体现上述反应能量变化的是_______。
A.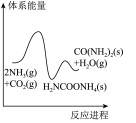 | B. | C.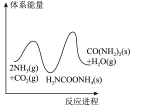 | D.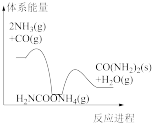 |
电解法处理含尿素废水的装置示意图如下图所示。

(6)该装置阳极的电极反应式为
(7)若废水中尿素的含量为
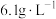 ,处理过的废水中尿素的含量低于
,处理过的废水中尿素的含量低于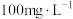 ,若两极共产生气体
,若两极共产生气体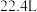 (标准状况下),理论上最多处理废水
(标准状况下),理论上最多处理废水(8)
 催化还原法能治理氮氧化物
催化还原法能治理氮氧化物 污染。如图所示是一定时间内,在不同温度下分别使用催化剂
污染。如图所示是一定时间内,在不同温度下分别使用催化剂 和
和 时的脱氮率,由此可知工业上使用的最佳催化剂和相应最佳温度分别为
时的脱氮率,由此可知工业上使用的最佳催化剂和相应最佳温度分别为 作催化剂时,脱氮率b~a段呈现如图所示变化的原因可能是
作催化剂时,脱氮率b~a段呈现如图所示变化的原因可能是
您最近一年使用:0次
解题方法
8 . 氧元素是在自然界中分布最广的元素,氧气在生产生活中有广泛的应用。
(1)一定压强下, 随温度升高时的熵(S)的具体数据如图所示:
随温度升高时的熵(S)的具体数据如图所示:
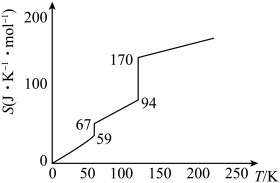
熵值由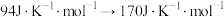 时,发生的变化是
时,发生的变化是___________ 。
(2)实验室可用 催化
催化 的分解制备
的分解制备 。
。
①用三个离子方程式表示该催化反应历程(反应机理)如下(请完成步骤Ⅰ):
步骤Ⅰ:___________ ;
步骤Ⅱ: ;
;
步骤Ⅲ: 。
。
②标准状态下,下列物质气态时的相对能量如下表:
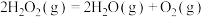

___________  。
。
根据上表中数据推测, 的键能
的键能___________ (填“>”、“<”或“=”) 中O—O键能的2倍。
中O—O键能的2倍。
 是工业上应用最广的助燃剂。以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。在C和
是工业上应用最广的助燃剂。以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。在C和 的体系中发生以下反应:
的体系中发生以下反应:
反应1:

反应2: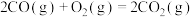

反应3:

③一定温度下的恒容密闭体系中,用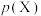 表示气体X的平衡分压。随着
表示气体X的平衡分压。随着 投料的不断增加,判断
投料的不断增加,判断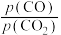 的比值
的比值___________ (填“变大、变小或不变”)。
④已知: ,且
,且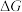 相等时K相等。反应1和反应3的
相等时K相等。反应1和反应3的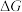 随温度T的变化关系如图所示(忽略
随温度T的变化关系如图所示(忽略 、
、 随温度的变化)。请在图中画出反应2的
随温度的变化)。请在图中画出反应2的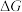 随温度的变化关系
随温度的变化关系___________ 。
(1)一定压强下,
 随温度升高时的熵(S)的具体数据如图所示:
随温度升高时的熵(S)的具体数据如图所示:
熵值由
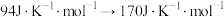 时,发生的变化是
时,发生的变化是(2)实验室可用
 催化
催化 的分解制备
的分解制备 。
。①用三个离子方程式表示该催化反应历程(反应机理)如下(请完成步骤Ⅰ):
步骤Ⅰ:
步骤Ⅱ:
 ;
;步骤Ⅲ:
 。
。②标准状态下,下列物质气态时的相对能量如下表:
| 物质(g) | O | H | HO | HOO |  |  |  |
能量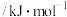 | 249 | 218 | 39 | 10 | 0 |  |  |
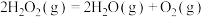

 。
。根据上表中数据推测,
 的键能
的键能 中O—O键能的2倍。
中O—O键能的2倍。 是工业上应用最广的助燃剂。以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。在C和
是工业上应用最广的助燃剂。以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。在C和 的体系中发生以下反应:
的体系中发生以下反应:反应1:


反应2:
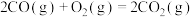

反应3:


③一定温度下的恒容密闭体系中,用
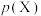 表示气体X的平衡分压。随着
表示气体X的平衡分压。随着 投料的不断增加,判断
投料的不断增加,判断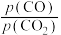 的比值
的比值④已知:
 ,且
,且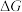 相等时K相等。反应1和反应3的
相等时K相等。反应1和反应3的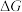 随温度T的变化关系如图所示(忽略
随温度T的变化关系如图所示(忽略 、
、 随温度的变化)。请在图中画出反应2的
随温度的变化)。请在图中画出反应2的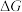 随温度的变化关系
随温度的变化关系
您最近一年使用:0次
名校
9 . 利用化学原理研究对废气进行脱硝处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。合理应用和处理氮氧化合物,在生产生活中有着重要的意义。
I.
(1)闪电时空气中的 和
和 会发生反应:
会发生反应: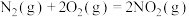
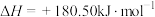 ,
,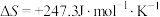 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
II.已知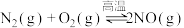 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。
(2)该温度下,向 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是___________ %(保留整数)。
(3)该温度下,某时刻测得容器内 、
、 、
、 的浓度分别为
的浓度分别为 、
、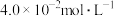 、
、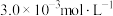 ,此时反应
,此时反应___________ (填“处于化学平衡状态”“正向进行”或“逆向进行”)。请说明理由___________ 。
(4)将 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是___________ 。
A.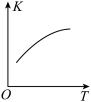 B.
B.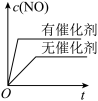 C.
C.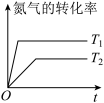
(5)向恒温恒容的密闭容器中充入等物质的量的 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数___________ (填“变大”“变小”或“不变”)。
I.
(1)闪电时空气中的
 和
和 会发生反应:
会发生反应: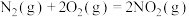
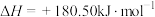 ,
,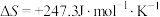 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。
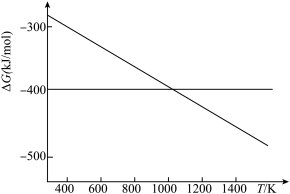
,若不考虑温度对该反应焓变的影响,则下列说法中正确的是___________。| A.在1000℃时,此反应能自发进行 |
| B.在1000℃时,此反应不能自发进行 |
| C.该反应能自发进行的最低温度约为730℃ |
D.该反应能自发进行的最高温度约为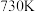 |
II.已知
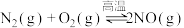 ,该反应在2404℃时的平衡常数
,该反应在2404℃时的平衡常数 。
。(2)该温度下,向
 密闭容器中充入
密闭容器中充入 与
与 各
各 ,平衡时
,平衡时 的转化率是
的转化率是(3)该温度下,某时刻测得容器内
 、
、 、
、 的浓度分别为
的浓度分别为 、
、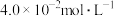 、
、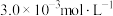 ,此时反应
,此时反应(4)将
 、
、 的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是
的混合气体充入恒温恒容密闭容器中,下图所示变化趋势正确的是A.
 B.
B. C.
C.
(5)向恒温恒容的密闭容器中充入等物质的量的
 与
与 ,达到平衡状态后再向其中充入一定量
,达到平衡状态后再向其中充入一定量 ,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中
,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中 的体积分数
的体积分数
您最近一年使用:0次
2023-04-15更新
|
400次组卷
|
3卷引用:上海市卢湾高级中学2022-2023学年高二下学期期中考试(等级考)化学试题
解题方法
10 . 丙烯是重要的化工原料,其用量仅次于乙烯,研究丙烯的制取工艺具有重要意义。丙烷催化脱氢制取丙烯的过程中涉及的主要反应有:
Ⅰ.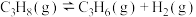

Ⅱ.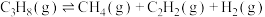
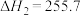 kJ·moL⁻¹
kJ·moL⁻¹
Ⅲ.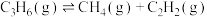
 kJ·moL⁻¹
kJ·moL⁻¹
已知:①温度高于600℃时,C-C键比C-H键更容易断裂;
②平衡状态下:
丙烯选择性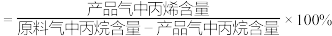
丙烯收率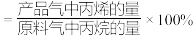
回答下列问题:
(1)下图中能正确表示反应Ⅰ的化学平衡常数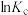 与温度T关系的是
与温度T关系的是_______ (填序号)。
a.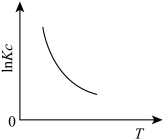 b.
b. 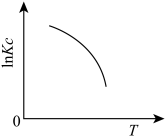 c.
c. 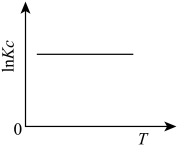 d.
d. 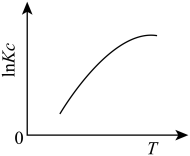
(2)在100kPa的恒压条件下,将1 mol 加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
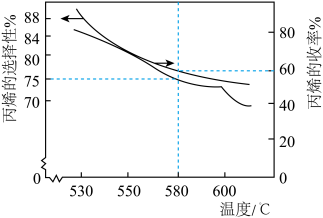
①温度高于600℃时丙烯的选择性降低幅度增大的原因是_______ 。
②580℃,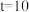 min时,反应体系达到平衡,丙烷的平衡转化率为
min时,反应体系达到平衡,丙烷的平衡转化率为_______ ,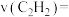
_______ kPa·min⁻¹。反应Ⅰ的压强平衡常数
_______ kPa(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)。
(3)工业上在保持100kPa的恒压条件下,通常在原料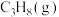 中掺混一定量惰性气体,掺混一定量惰性气体的原理是
中掺混一定量惰性气体,掺混一定量惰性气体的原理是_______ 。
Ⅰ.
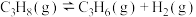

Ⅱ.
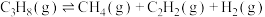
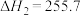 kJ·moL⁻¹
kJ·moL⁻¹Ⅲ.
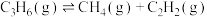
 kJ·moL⁻¹
kJ·moL⁻¹已知:①温度高于600℃时,C-C键比C-H键更容易断裂;
②平衡状态下:
丙烯选择性
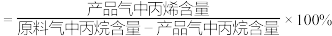
丙烯收率
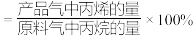
回答下列问题:
(1)下图中能正确表示反应Ⅰ的化学平衡常数
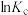 与温度T关系的是
与温度T关系的是a.
 b.
b.  c.
c.  d.
d. 
(2)在100kPa的恒压条件下,将1 mol
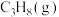 加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
加入密闭容器中,在催化条件下发生上述反应,实验测得温度对平衡状态下丙烯的选择性和收率的影响如图所示。
①温度高于600℃时丙烯的选择性降低幅度增大的原因是
②580℃,
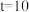 min时,反应体系达到平衡,丙烷的平衡转化率为
min时,反应体系达到平衡,丙烷的平衡转化率为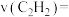

(3)工业上在保持100kPa的恒压条件下,通常在原料
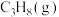 中掺混一定量惰性气体,掺混一定量惰性气体的原理是
中掺混一定量惰性气体,掺混一定量惰性气体的原理是
您最近一年使用:0次
2023-02-22更新
|
0次组卷
|
3卷引用:山东省济宁市泗水县2023-2024学年高二上学期期中考试化学试题



