1 . 某化学兴趣小组为探究 溶液与
溶液与 溶液之间的反应,进行如下实验:
溶液之间的反应,进行如下实验:

下列说法中正确的是
 溶液与
溶液与 溶液之间的反应,进行如下实验:
溶液之间的反应,进行如下实验:
下列说法中正确的是
A.实验①溶液变色,证明 与 与 的反应为可逆反应 的反应为可逆反应 |
| B.实验②、③中氧化还原反应的平衡移动方向相反 |
C.取实验②所得溶液加入 ,溶液红色变浅 ,溶液红色变浅 |
D.黄褐色溶液经实验③后水溶液中的 增大 增大 |
您最近一年使用:0次
2023-02-19更新
|
203次组卷
|
3卷引用:四川省绵阳市2022-2023学年高二上学期期末教学质量测试化学试题
四川省绵阳市2022-2023学年高二上学期期末教学质量测试化学试题(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)课时3影响化学平衡的因素随堂练习
名校
2 . 将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:

下列说法不正确的是

下列说法不正确的是
| A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动 |
| B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动 |
| C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动 |
| D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动 |
您最近一年使用:0次
2018-11-13更新
|
244次组卷
|
7卷引用:四川省广安市邻水实验学校2018-2019学年高二上学期第三次月考化学试题
四川省广安市邻水实验学校2018-2019学年高二上学期第三次月考化学试题四川省邻水市实验中学2019-2020学年高二12月月考化学试题福建省南安第一中学2019-2020学年高二上学期第一次阶段考试化学试题(已下线)2019年12月25日《每日一题》人教版(选修4)—— 影响化学平衡的因素(已下线)2.3.1 浓度对化学平衡的影响(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)【区级联考】北京市海淀区2019届高三第一学期期中考试化学试题【校级联考】甘肃省民乐一中、张掖二中2019届高三上学期第一次调研考试(12月)理科综合化学试题
名校
3 . 新制氢氧化铜存在平衡:Cu(OH)2 +2OH-⇌ (深蓝色)。某同学进行下列实验:
(深蓝色)。某同学进行下列实验:
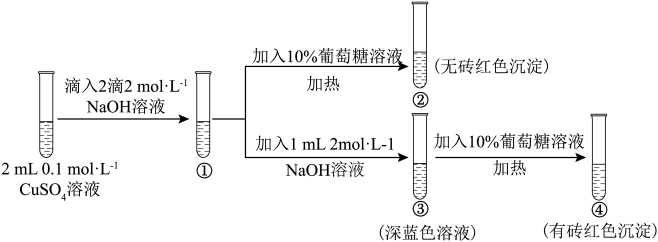
下列说法不正确 的是
 (深蓝色)。某同学进行下列实验:
(深蓝色)。某同学进行下列实验:
下列说法
| A.①中出现蓝色沉淀 |
B.③中现象是Cu(OH)2 +2OH-⇌ 正向移动的结果 正向移动的结果 |
| C.④中现象证明葡萄糖具有还原性 |
D.对比②和④可知Cu(OH)2氧化性强于 |
您最近一年使用:0次
2017-02-17更新
|
747次组卷
|
10卷引用:四川省双流中学2018-2019学年高二6月月考化学试题
四川省双流中学2018-2019学年高二6月月考化学试题【全国百强校】北京师范大学附属中学2017-2018学年高二下学期期中考试化学试题【全国百强校】北京101中学2017-2018学年高二下学期期中考试化学试题安徽省定远县育才学校2019-2020学年高二下学期期末考试化学试题(已下线)2.3.1 浓度对化学平衡的影响(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)湖南省常德市一中2020-2021学年高二上学期期末考试化学试题第四章 生物大分子2017届北京市海淀区高三上学期期末化学试卷北京市中央民族大学附属中学2022届高三9月月考化学试题(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
4 . 根据下列实验操作与现象所得出的结论正确的是
| 选项 | 实验操作与现象 | 结论 |
| A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液由浅绿色变为黄色 | 氧化性:H2O2>>Fe2+ |
| B | 向4mL0.1mol/LK2CrO4溶液中缓慢滴加1molL稀硫酸,溶液由黄色变为橙色 | 增大c(H+)有利于 转化为 转化为 |
| C | 等体积pH=2的HX和HY两种酸溶液分别与足量的锌粒反应,用排水法收集气体,HX溶液放出的氢气多且反应速率快 | 证明HX的酸性比HY强 |
| D | 室温下,向浓度均为0.05mol/L的NaI和NaCl的混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgI)>Ksp(AgCI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 下列实验过程不能达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 提高饱和氯水中的HClO浓度 | 向饱和氯水中加入碳酸钙粉末并通入适量Cl2,然后过滤 |
| B | 证明压强对平衡移动产生影响 | 向充有NO2和N2O4混合气体的恒容透明密闭容器中充入氦气增大压强,观察现象 |
| C | 探究浓度对化学平衡的影响 | 试管中盛有0.1 mol·L−1 K2Cr2O7溶液,向其中滴加10滴6 mol·L−1 NaOH溶液,观察到溶液黄色加深 |
| D | 比较CdS(黄色)与CuS(黑色)的溶解度[已知Ksp(CdS)>Ksp(CuS)] | 向H2S溶液中滴加0.01mol·L-1的CdSO4溶液至沉淀不再增加,然后滴入几滴0.01 mol·L-1CuSO4溶液,观察沉淀颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-07更新
|
139次组卷
|
2卷引用:四川省成都石室中学2023-2024学年高二上学期期中考试化学试卷
名校
解题方法
6 . 下列实验中,不能 达到实验目的是
| A | B | C | D |
验证平衡: | 证明 | 测定HCl溶液的浓度 | 由FeCl3溶液制取无水FeCl3固体 |
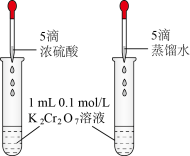 |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-20更新
|
79次组卷
|
2卷引用:四川省内江市第六中学2023-2024学年高二上学期第二次月考化学试卷
解题方法
7 . 下列离子方程式不正确的是
| A.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
B.草酸溶液中滴加酸性高锰酸钾溶液:5C2O +2MnO +2MnO +16H+=2Mn2++10CO2↑+8H2O +16H+=2Mn2++10CO2↑+8H2O |
C.K2Cr2O7溶液中加入氢氧化钠溶液,溶液颜色由橙色变为黄色证明溶液中存在平衡:Cr2O +H2O +H2O 2CrO 2CrO +2H+ +2H+ |
D.浓硝酸中加入少量铁粉并加热:Fe+3NO +6H+ +6H+ Fe3++3NO2↑+3H2O Fe3++3NO2↑+3H2O |
您最近一年使用:0次
8 . 下列实验操作与实验目的均正确的是
| 选项 | 实验操作 | 实验目的 |
| A | 将5mL0.1mol•L-1Na2S2O3溶液和5mL0.1mol•L-1H2SO4溶液混合后,均分至两支试管,一支放入冷水中,另一支放入热水中,观察现象 | 探究温度对反应速率的影响 |
| B | 向两支分别盛有等浓度的醋酸和硼酸溶液的试管中滴加等浓度的NaHCO3溶液,观察是否产生气泡 | 探究醋酸、碳酸、硼酸的酸性强弱 |
| C | 向盛有5mL0.1mol•L-1AgNO3溶液的试管中先滴加10滴0.1mol•L-1NaCl溶液,再滴加10滴0.1mol•L-1KI溶液,观察是否产生黄色沉淀 | 证明溶解度:AgCl>AgI |
| D | 向盛有FeCl3和KSCN混合溶液的试管中加入KCl固体,观察现象 | 探究浓度对化学平衡的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 根据实验目的,下列实验及现象、结论都正确的是
| 选项 | 实验目的 | 实验及现象 | 结论 |
| A | 比较S、C的非金属性 | 分别测定等物质的量浓度的H2SO3和H2CO3溶液的pH,后者较大 | 证明非金属性:S>C |
| B | 检验某溶液中是否含二价铁离子 | 取少量溶液于试管中,滴入酸性高锰酸钾溶液,紫色褪去 | 证明溶液含有二价铁 |
| C | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向K2Cr2O7溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| D | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-21更新
|
102次组卷
|
3卷引用:四川省内江市威远中学校2022-2023学年高二上学期第二次月考(期中考试)化学试题
名校
10 . 某小组设计实验研究单一组分浓度对化学平衡2Fe3++2I- 2Fe2++I2的影响。
2Fe2++I2的影响。
(1)①待试管中溶液的颜色不变后再进行后续实验,其目的是___________ 。
②加入KSCN溶液的目的是___________ 。
(2)甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2.
本实验改用0.1 mol•L-1KI溶液的目的是___________ 。
(3)实验3:研究增大反应物Fe3+浓度对平衡的影响,实验方法如下:
取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和FeCl3溶液,溶液颜色加深,原因是:增大Fe3+浓度,导致Q___________ K(填“>”或“<”),平衡向___________ (填“正反应”或“逆反应”)方向移动。
(4)实验4:研究增大生成物Fe2+浓度对平衡的影响,实验方案如图所示:
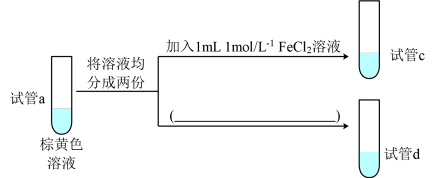
①请在图中将方案补充完整___________ 。
②能够证明增大生成物Fe2+浓度导致平衡移动的实验现象为___________ 。
 2Fe2++I2的影响。
2Fe2++I2的影响。| 实验1 | 实验步骤 | 实验现象 |
| i.取2 mL1 mol•L﹣1KI溶液,滴加0.1 mol•L-1FeCl3溶液2 mL。 | i.溶液呈棕黄色。 | |
| ii.待试管中溶液的颜色不变后向其中滴加2滴0.1 mol•L-1KSCN溶液。 | ii.溶液不显红色。 |
(1)①待试管中溶液的颜色不变后再进行后续实验,其目的是
②加入KSCN溶液的目的是
(2)甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2.
| 实验2 | 实验现象 | 实验步骤 |
| i.取2 mL0.1 mol•L﹣1KI溶液于试管a中,滴加0.1 mol•L-1FeCl3溶液2mL | i.溶液呈棕黄色 | |
| ii.待试管中溶液的颜色不变后,取少量试管a中溶液于试管b中,滴加2滴0.1 mol•L-1KSCN溶液。 | ii.溶液显红色 |
本实验改用0.1 mol•L-1KI溶液的目的是
(3)实验3:研究增大反应物Fe3+浓度对平衡的影响,实验方法如下:
取少量试管a中棕黄色溶液于试管中,加入1~2滴饱和FeCl3溶液,溶液颜色加深,原因是:增大Fe3+浓度,导致Q
(4)实验4:研究增大生成物Fe2+浓度对平衡的影响,实验方案如图所示:

①请在图中将方案补充完整
②能够证明增大生成物Fe2+浓度导致平衡移动的实验现象为
您最近一年使用:0次
2021-12-04更新
|
143次组卷
|
2卷引用:四川省泸县第四中学2022-2023学年高二上学期期中考试化学试题



