1 . 为探究FeCl3溶液与Na2SO3溶液的反应,某研究小组的同学提出两种观点。
(1)观点一:两溶液混合发生氧化还原反应,离子方程式为_______ 。
观点二:_______ ,离子方程式为_______ 。
为验证上述观点,该研究小组的同学设计了探究实验(FeCl3溶液和Na2SO3溶液的浓度均为1.0mol·L-1)。
(2)实验①的目的是_______ 。
(3)对比实验①②的现象,可得结论:_______ 。
(4)将实验②反应后的溶液放置3小时后,溶液变为浅黄绿色,试提出合理的解释:_______ 。
(5)实验③的现象说明二者混合只发生_______ 反应,原因是_______ 。
(6)对比实验②③可得影响反应的因素可能有_______ 。
(1)观点一:两溶液混合发生氧化还原反应,离子方程式为
观点二:
为验证上述观点,该研究小组的同学设计了探究实验(FeCl3溶液和Na2SO3溶液的浓度均为1.0mol·L-1)。
| 实验 | 操作与现象 |
| ① | 在5mL水中滴加2滴FeCl3溶液,呈棕黄色;煮沸,溶液变红褐色 |
| ② | 在5mLFeCl3溶液中滴加2滴Na2SO3溶液,溶液立即变为红褐色;再滴加 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
| ③ | 在5mLNa2SO3溶液中滴加2滴FeCl3溶液,溶液立即变为红褐色;将上述混合液分成两份,一份滴加 溶液,无蓝色沉淀生成;另一份煮沸产生红褐色沉淀,再加 溶液,无蓝色沉淀生成;另一份煮沸产生红褐色沉淀,再加 溶液,无蓝色沉淀生成 溶液,无蓝色沉淀生成 |
(3)对比实验①②的现象,可得结论:
(4)将实验②反应后的溶液放置3小时后,溶液变为浅黄绿色,试提出合理的解释:
(5)实验③的现象说明二者混合只发生
(6)对比实验②③可得影响反应的因素可能有
您最近一年使用:0次
2023-05-16更新
|
477次组卷
|
4卷引用:河南省郑州市等3地2023届高三下学期6月理综化学试题
河南省郑州市等3地2023届高三下学期6月理综化学试题河北省秦皇岛市青龙满族自治县2023届高三三模联考化学试题(已下线)专题19 实验综合题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)
名校
解题方法
2 . 某小组同学探究盐对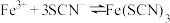 平衡体系的影响。
平衡体系的影响。
实验Ⅰ:探究KCl对 和
和 平衡体系的影响
平衡体系的影响
将等体积、低浓度的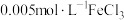 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和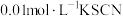 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
② 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。
(1)稀盐酸酸化 溶液的目的是
溶液的目的是___________ 。采用浓度较低的 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免___________ (填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向___________ (填“正”或“逆”)反应方向移动。
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。
(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
①上述实验可证明盐效应影响了 和
和 平衡体系的是
平衡体系的是___________ (填字母序号)。
a.1和2 b.1和3 c.1和4
②选择实验___________ (填序号)可得出结论: 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。
(4)取等体积的溶液a继续进行实验,结果如下表。
上述实验可证明副反应影响了 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:___________ 。
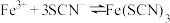 平衡体系的影响。
平衡体系的影响。实验Ⅰ:探究KCl对
 和
和 平衡体系的影响
平衡体系的影响将等体积、低浓度的
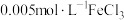 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和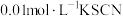 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②
 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。(1)稀盐酸酸化
 溶液的目的是
溶液的目的是 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免(2)从实验结果来看,KCl溶液确实对
 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使
 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。原因2:溶液中存在副反应
 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
| 序号 | 加入少量盐 | 溶液颜色 |
| 1 | 无 | 红色 |
| 2 | KCl | 变浅 |
| 3 |  | 略变浅 |
| 4 | NaCl | 变浅程度较大 |
 和
和 平衡体系的是
平衡体系的是a.1和2 b.1和3 c.1和4
②选择实验
 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。(4)取等体积的溶液a继续进行实验,结果如下表。
| 序号 | 加入溶液 | 溶液颜色 |
| 5 | 1mL浓盐酸 | 明显变浅,溶液偏黄 |
| 6 | 1mL去离子水 | 略变浅 |
 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:
您最近一年使用:0次
2023-04-20更新
|
117次组卷
|
4卷引用:河南省郑州市宇华实验学校2023-2024学年高二下学期开学考试化学试题
名校
3 . 已知K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
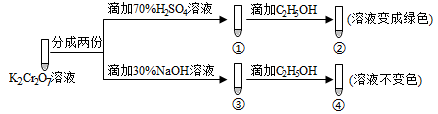
结合实验,下列说法正确的是
 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
结合实验,下列说法正确的是
| A.①中溶液变黄,③中溶液橙色加深 |
| B.上述可逆反应的平衡常数:①<③ |
| C.K2Cr2O7溶液的氧化性在酸性条件下更强 |
| D.若向④中加入70%H2S04溶液至过量,溶液变为橙色 |
您最近一年使用:0次
2017-03-31更新
|
560次组卷
|
4卷引用:2017届河南省郑州、平顶山、濮阳市高三第二次质量预测(二模)理综化学试卷



