名校
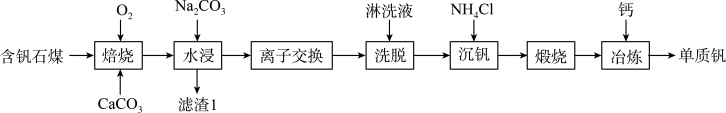
1 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是 、
、 ,含有的杂质有
,含有的杂质有 、
、 及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
已知:
①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
② ,
, ,
, 远大于
远大于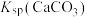 。
。
回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施有___________ 、___________ 。
(2)“焙烧”时, 、
、 都转化为
都转化为 ,写出
,写出 转化为
转化为 的化学方程式:
的化学方程式:___________ 。
(3)“水浸”加入 调节溶液的pH为8.5,可完全除去的金属离子有
调节溶液的pH为8.5,可完全除去的金属离子有___________ ,部分除去的金属离子有___________ 。“水浸”加入过量 不能使
不能使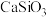 完全转化为
完全转化为 ,原因是
,原因是___________ 。
(4)“离子交换”与“洗脱”可表示为 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用___________ 。
(5)“沉钒”过程析出 晶体,需要加入过量
晶体,需要加入过量 ,目的是
,目的是___________ 。
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。
 、
、 ,含有的杂质有
,含有的杂质有 、
、 及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
已知:
①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
 ,
, ,
, 远大于
远大于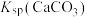 。
。回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施有
(2)“焙烧”时,
 、
、 都转化为
都转化为 ,写出
,写出 转化为
转化为 的化学方程式:
的化学方程式:(3)“水浸”加入
 调节溶液的pH为8.5,可完全除去的金属离子有
调节溶液的pH为8.5,可完全除去的金属离子有 不能使
不能使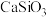 完全转化为
完全转化为 ,原因是
,原因是(4)“离子交换”与“洗脱”可表示为
 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂, 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(5)“沉钒”过程析出
 晶体,需要加入过量
晶体,需要加入过量 ,目的是
,目的是(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是___________(填字母)。
| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
解题方法
2 . 铜阳极泥含有Cu、Ag、Pt、Au、Ag2Se和Cu2S等,下图是从中回收Se和贵重金属的工艺:

已知:
①该工艺中萃取与反萃取原理为2RH+Cu2+⇌R2Cu+2H+;
② 在碱性条件下很稳定,易与Ag+络合:Ag++2
在碱性条件下很稳定,易与Ag+络合:Ag++2 ⇌[Ag(S2O3)2]3-,常温下该反应的平衡常数K=2.80×1013。
⇌[Ag(S2O3)2]3-,常温下该反应的平衡常数K=2.80×1013。
回答下列问题:
(1)写出“焙烧”时Ag2Se生成Ag2O的化学方程式_______ ,“洗气”时n(氧化剂):n(还原剂)=_______ 。
(2)写出“滤渣I”的一种用途_______ ;“酸浸氧化”中通入气体X可防止污染,写出X的名称_______ 。
(3)在实验室进行萃取操作所需的玻璃仪器_______ 。“反萃取剂”最好选用_______ (填化学式)溶液。
(4)“溶浸”中发生的反应为AgCl(s)+2 (aq)⇌[Ag(S2O3)2]3-(aq)+C1-(aq),通过计算说明该反应能否进行完全:
(aq)⇌[Ag(S2O3)2]3-(aq)+C1-(aq),通过计算说明该反应能否进行完全:_______ 。[已知Ksp(AgCl)=1.80×10-10]。
(5)“滤液IV”中含有Na2SO3,则“还原”中发生反应的离子方程式为_______ 。“滤液IV”可返回“溶浸”工序循环使用,但循环多次后,银的浸出率会降低,原因是_______ (试用平衡原理解释)。

已知:
①该工艺中萃取与反萃取原理为2RH+Cu2+⇌R2Cu+2H+;
②
 在碱性条件下很稳定,易与Ag+络合:Ag++2
在碱性条件下很稳定,易与Ag+络合:Ag++2 ⇌[Ag(S2O3)2]3-,常温下该反应的平衡常数K=2.80×1013。
⇌[Ag(S2O3)2]3-,常温下该反应的平衡常数K=2.80×1013。回答下列问题:
(1)写出“焙烧”时Ag2Se生成Ag2O的化学方程式
(2)写出“滤渣I”的一种用途
(3)在实验室进行萃取操作所需的玻璃仪器
(4)“溶浸”中发生的反应为AgCl(s)+2
 (aq)⇌[Ag(S2O3)2]3-(aq)+C1-(aq),通过计算说明该反应能否进行完全:
(aq)⇌[Ag(S2O3)2]3-(aq)+C1-(aq),通过计算说明该反应能否进行完全:(5)“滤液IV”中含有Na2SO3,则“还原”中发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 硫氰酸钾(KSCN),是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。
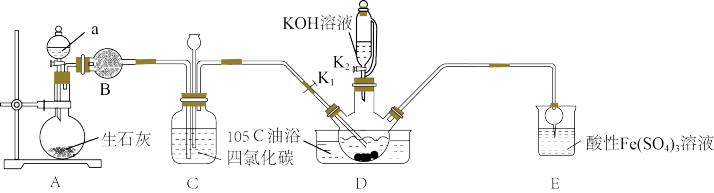
已知:① 不溶于
不溶于 和
和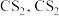 不溶于水且密度比水大;
不溶于水且密度比水大;
②D中三颈烧瓶内盛放 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃时易分解,
在高于170℃时易分解, 在高于25℃时即分解。
在高于25℃时即分解。
回答下列问题:
(1)试剂a是____ ,装置D中盛装KOH溶液的仪器名称是_______ 。
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是___ 。
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是___ 。
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经___ (填操作名称)、减压蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰酸钾晶体。
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因___ 。
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:____ 。

已知:①
 不溶于
不溶于 和
和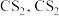 不溶于水且密度比水大;
不溶于水且密度比水大;②D中三颈烧瓶内盛放
 、水和催化剂,发生反应
、水和催化剂,发生反应 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃时易分解,
在高于170℃时易分解, 在高于25℃时即分解。
在高于25℃时即分解。回答下列问题:
(1)试剂a是
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E中发生氧化还原反应的离子方程式是
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经
(5)取少量所得KSCN晶体配成溶液,将装置E中混合液过滤得溶液x,进行如下实验:

①设计实验探究ⅱ中银镜产生的原因
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:
您最近一年使用:0次
2021-03-11更新
|
1366次组卷
|
7卷引用:山东省潍坊市2021届高三第一次模拟考试化学试题
山东省潍坊市2021届高三第一次模拟考试化学试题辽宁省葫芦岛市2021届高三第二次模拟考试化学试题福建省厦门外国语学校2021届高三5月高考适应性考试化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)第二章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)
名校
解题方法
4 . 钴是元素周期表第四周期第Ⅷ族元素,其化合物用途广泛。如: 作锂电池的正极材料。
作锂电池的正极材料。
I.(1)基态Co原子的价层电子排布式为_______ 。
II.利用原钴矿 (含
(含 、NiS等杂质)制备
、NiS等杂质)制备 的工艺流程如下:
的工艺流程如下:
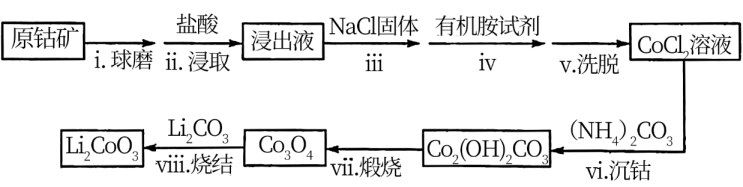
资料:①在含一定量 的溶液中:
的溶液中: 。
。
② 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。
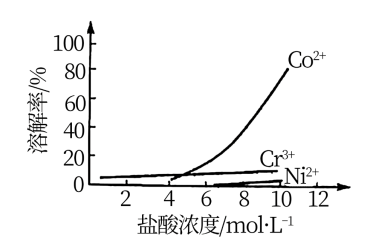
③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
(2)步骤i的目的是_______ 。
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:_______ 。
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是_______ 。
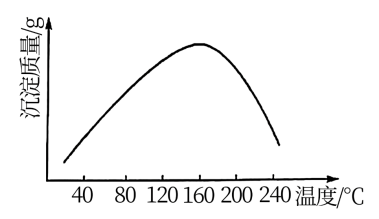
(5)步骤vi用 作沉钴剂,在一定条件下得到碱式碳酸钴
作沉钴剂,在一定条件下得到碱式碳酸钴 。实验测得在一段时间内加入等量
。实验测得在一段时间内加入等量 所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因___ 。
(6)步骤vi沉钴中(常温下进行),若滤液中 含量为
含量为 ,此时溶液的pH为
,此时溶液的pH为___ 。
(7)步骤viii中 和
和 混合后,鼓入空气,经高温烧结得到
混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
。该反应的化学方程式是_______ 。
 作锂电池的正极材料。
作锂电池的正极材料。I.(1)基态Co原子的价层电子排布式为
II.利用原钴矿
 (含
(含 、NiS等杂质)制备
、NiS等杂质)制备 的工艺流程如下:
的工艺流程如下:
资料:①在含一定量
 的溶液中:
的溶液中: 。
。②
 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:

(2)步骤i的目的是
(3)步骤ii中出现了淡黄色沉淀,写出发生该反应的离子方程式:
(4)从平衡移动角度解释步骤iii中加入NaCl固体的目的是
(5)步骤vi用
 作沉钴剂,在一定条件下得到碱式碳酸钴
作沉钴剂,在一定条件下得到碱式碳酸钴 。实验测得在一段时间内加入等量
。实验测得在一段时间内加入等量 所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
所得沉淀质量随反应温度的变化如图所示,分析曲线下降的原因
(6)步骤vi沉钴中(常温下进行),若滤液中
 含量为
含量为 ,此时溶液的pH为
,此时溶液的pH为
(7)步骤viii中
 和
和 混合后,鼓入空气,经高温烧结得到
混合后,鼓入空气,经高温烧结得到 。该反应的化学方程式是
。该反应的化学方程式是
您最近一年使用:0次
2021-03-04更新
|
253次组卷
|
2卷引用:辽宁省名校联盟2021届高三3月联合考试化学试题
5 . 铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水。
I.还原沉淀法是处理含CrO42-和Cr2O72-工业废水的一种常用方法,其工艺流程如下:
其中,第I步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系中,pH=0时溶液呈______ 色。
(2)以石墨为电极,电解Na2CrO4制备Na2CrO7的装置如图所示,a极的名称是_______ ;第I步中b极直接相连一极的反应式为_______________ 。
(3)第II步的离子方程式为______________ ;向第II步反应后的溶液中加入一定量烧碱,若溶液中c(Fe3+)=2.0×10-12mol/L,则溶液中c(Cr3+)=_______ mol/L。
(已知:Ksp[Fe(OH)3]=4.0×10-38mol/L,Ksp[Cr(OH)3]=6.0×10-31mol/L)
II.探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛然反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:a CrO3+bC2H5OH+cH2SO4=d Cr2(SO4)3+eCH3COOH+fR
b:c:f=_________ 。
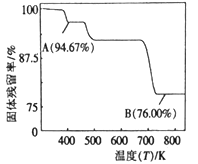
(5)CrO3的热稳定性差,加热时逐步分解,其固体残解率随温度的变化如图所示。B点时生成固体的化学式为______ 。( )。
)。
I.还原沉淀法是处理含CrO42-和Cr2O72-工业废水的一种常用方法,其工艺流程如下:

其中,第I步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O(1)若平衡体系中,pH=0时溶液呈
(2)以石墨为电极,电解Na2CrO4制备Na2CrO7的装置如图所示,a极的名称是

(3)第II步的离子方程式为
(已知:Ksp[Fe(OH)3]=4.0×10-38mol/L,Ksp[Cr(OH)3]=6.0×10-31mol/L)
II.探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛然反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:a CrO3+bC2H5OH+cH2SO4=d Cr2(SO4)3+eCH3COOH+fR
b:c:f=
(5)CrO3的热稳定性差,加热时逐步分解,其固体残解率随温度的变化如图所示。B点时生成固体的化学式为
 )。
)。
您最近一年使用:0次



