名校
解题方法
1 . 实验室探究NaHSO3溶液与Cu2+的反应。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是____ 。
(2)写出C中制备NaHSO3的离子方程式____ 。
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:
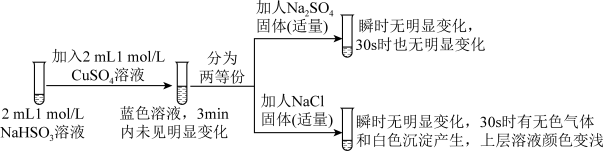
已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO 的还原性
的还原性
b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是_____ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
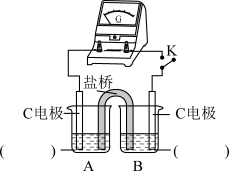
ⅰ.补全电化学装置示意图____ 。
ⅱ.写出B中的电极反应方程式____ 。
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,____ ,使HSO 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+ HAuCl4
HAuCl4
(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:____ 。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备NaHSO3的离子方程式
II.探究NaHSO3溶液与Cu2+的反应,过程如图所示:

已知:硫酸亚铜易溶于水。
回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因。
a.Cl-改变了HSO
 的还原性
的还原性b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 | 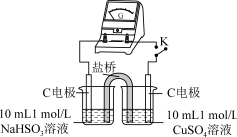 | 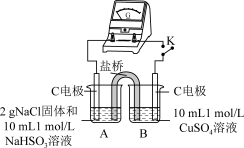 |
| 现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

ⅰ.补全电化学装置示意图
ⅱ.写出B中的电极反应方程式
ⅲ.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,
 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。III.金能与浓硝酸发生微弱反应生成Au3+,短时间几乎观察不到金溶解。金易溶于“王水”[浓硝酸与浓盐酸按体积比1∶3混合]
已知:Au3++4Cl-+H+
 HAuCl4
HAuCl4(4)利用(3)中实验探究的结论,分析“王水”溶金的原理:
您最近一年使用:0次
解题方法
2 . 资料显示,I2-KI溶液可以清洗银镜。某小组同学设计实验探究银镜在I2-KI溶液中的溶解情况。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I− I
I (棕色),I2和I
(棕色),I2和I 氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】_____ 。
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是_____ 。
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
(3)ⅰi中,搅拌后银镜继续溶解的原因是_____ 。
(4)由i、iii可得到的结论是_____ 。
(5)设计iv的目的是_____ 。
探究3:I−的作用
【实验v】
说明:本实验中,检流计读数越大,说明氧化剂氧化性(或还原剂还原性)越强。
(6)步骤1接通电路后,正极的电极反应物为_____ 。
(7)补全步骤3的操作及现象:_____ ,_____ 。
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:_____ 。
已知:I2微溶于水,易溶于KI溶液,并发生反应I2+I−
 I
I (棕色),I2和I
(棕色),I2和I 氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。
氧化性几乎相同;[Ag(S2O3)2]3−在水溶液中无色。探究1:I2-KI溶液(向1mol·L−1KI溶液中加入I2至饱和)溶解银镜
【实验i】
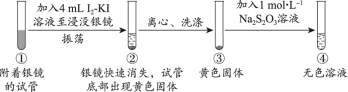
(2)能证明②中Ag已全部反应、未被包裹在黄色固体内的实验证据是
探究2:I2-KI溶液能快速溶解银镜的原因
【实验ii~iv】向附着银镜的试管中加入相应试剂至浸没银镜,记录如下:
| 序号 | 加入试剂 | 实验现象 |
| ⅰi | 4mL饱和碘水(向水中加入I2至饱和, | 30min后,银镜少部分溶解,溶液棕黄色变浅;放置24h后,与紫黑色固体接触部分银镜消失,紫黑色固体表面上有黄色固体,上层溶液接近无色;搅拌后,银镜继续溶解 |
| ⅱi | 4mL饱和碘水和0.66gKI固体(溶液中KI约1mol·L−1) | 15min后银镜部分溶解,溶液棕黄色变浅;放置24h后,试管壁上仍有未溶解的银镜,溶液无色 |
| iv | 4mL1mol·L−1KI溶液 | 放置24h,银镜不溶解,溶液无明显变化 |
(4)由i、iii可得到的结论是
(5)设计iv的目的是
探究3:I−的作用
【实验v】
| 实验装置 | 实验步骤及现象 |
| 1.按左图搭好装置,接通电路,检流计指针向 右微弱偏转,检流计读数为amA; 2.向石墨电极附近滴加饱和碘水,指针继续向 右偏转,检流计读数为bmA(b>a); 3.向左侧烧杯中加入_____,指针继续向右偏转,检流计读数cmA(c>b),有_____生成。 |
(6)步骤1接通电路后,正极的电极反应物为
(7)补全步骤3的操作及现象:
(8)综合上述探究,从反应速率和物质性质的角度分析i中I2-KI溶液能快速全部溶解银镜的原因:
您最近一年使用:0次
2024-04-13更新
|
422次组卷
|
2卷引用:2023-2024学年海淀区第二学期期中考试高三化学试卷
解题方法
3 . 文献表明:相同条件下,草酸根(C2O42-)的还原性强于Fe2+。为检验这一结论, 完成如下实验。
资料:i.草酸(H2C2O4)为二元弱酸。
ii.三水三草酸合铁酸钾K3 Fe(C2O4)3·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:
[Fe(C2O4)3]3- Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21
iii. FeC2O4·2H2O为黄色固体,微溶于水,可溶于强酸。
[实验1]通过Fe3+和C2O42-在溶液中的反应比较Fe2+和C2O42-的还原性强弱。
(l) C2O42-中碳元素的化合价是____ 。
(2)取实验1中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是____ 。
(3)经检验,翠绿色晶体为K3 Fe(C2O4)3·3H2O设计实验,确认实验1中没有发生氧化还原反应的操作和现象是____ 。实验l中未发生氧化还原反应的原因是____ 。
(4)取实验1中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:
_____ [Fe(C2O4)3]3-+_____ H2O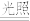
____ FeC2O4·2H2O↓+_____ +________ 。
[实验2]通过比较H2O2与Fe2+、C2O42-反应的难易,判断二者还原性的强弱。
(5)证明Fe2+被氧化的实验现象是____ 。
(6)以上现象能否说明C2O42-没有被氧化。请判断并说明理由:________
(7)用FeC13溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和C2O42-的还原性强弱。画出装置图并描述预期现象:____ 。
资料:i.草酸(H2C2O4)为二元弱酸。
ii.三水三草酸合铁酸钾K3 Fe(C2O4)3·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:
[Fe(C2O4)3]3-
 Fe3++3C2O42- K=6.3×10-21
Fe3++3C2O42- K=6.3×10-21iii. FeC2O4·2H2O为黄色固体,微溶于水,可溶于强酸。
[实验1]通过Fe3+和C2O42-在溶液中的反应比较Fe2+和C2O42-的还原性强弱。
| 操作 | 现象 |
| 在避光处,向10 mL 0.5 mol·L-1 FeCl3溶液中缓慢加入0.5 mol·L-1 K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到翠绿色溶液和翠绿色晶体 |
(2)取实验1中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是
(3)经检验,翠绿色晶体为K3 Fe(C2O4)3·3H2O设计实验,确认实验1中没有发生氧化还原反应的操作和现象是
(4)取实验1中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:
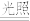
[实验2]通过比较H2O2与Fe2+、C2O42-反应的难易,判断二者还原性的强弱。
| 步骤 | 操作 | 现象 |
| I | 向l mL 0.5 mol·L-1 FeSO4溶液中加入1 mL 0.5 mol·L-1 K2C2O4溶液,过滤 | 立即产生黄色沉淀 |
| II | 洗涤Ⅰ中的黄色沉淀,向其中加入过量的6%H2O2溶液,振荡,静置 | 剧烈放热,产生大量的红褐色沉淀和无色气体 |
| III | 待充分反应后,向其中加入稀硫酸,调节pH约为4 | 得到翠绿色溶液 |
(6)以上现象能否说明C2O42-没有被氧化。请判断并说明理由:
(7)用FeC13溶液、K2C2O4溶液和其他试剂,设计实验方案比较Fe2+和C2O42-的还原性强弱。画出装置图并描述预期现象:
您最近一年使用:0次
4 . 乙烯合成的发展体现了化学科学与技术的不断进步。
(1)用烃类热裂解法制乙烯是乙烯工业化生产的开端。
①乙烷高温裂解制备乙烯(反应Ⅰ)的化学方程式是______ 。
②在裂解过程中伴随反应Ⅱ: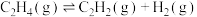 ,在高温下缩短
,在高温下缩短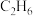 在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ
在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ______ 反应Ⅱ。(填“>”“<”或“=”)
(2)乙炔选择性加氢制乙烯是石油化工领域重要的发展阶段。
以钯(Pd)为催化剂可有效提高乙烯产率,在催化剂表面的反应机理如下图所示(吸附在催化剂表面的粒子用*标注)。______ 。
a.NP-Pd催化反应过程中步骤Ⅰ为放热反应
b.ISA-Pd催化反应过程中步骤Ⅱ为决速步骤
c.两种催化剂均能降低总反应的反应热
②吸附态乙烯( )脱离催化剂表面,可得到
)脱离催化剂表面,可得到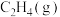 ,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制
,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制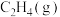 选择性较好的催化剂是
选择性较好的催化剂是______ 。
(3)以 为原料用不同的方法制乙烯有助于实现碳中和。
为原料用不同的方法制乙烯有助于实现碳中和。
I.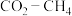 干气重整制乙烯。下图是2种投料比[
干气重整制乙烯。下图是2种投料比[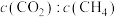 ,分别为1:1、2:1]下,反应温度对
,分别为1:1、2:1]下,反应温度对 平衡转化率影响的曲线。
平衡转化率影响的曲线。______ 。
②当曲线a、b对应的投料比达到相同的 平衡转化率时,对应的反应温度与投料比的关系是
平衡转化率时,对应的反应温度与投料比的关系是______ 。
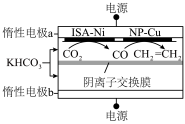
Ⅱ.双金属串联催化剂电催化 制乙烯,装置示意图如图所示。
制乙烯,装置示意图如图所示。
已知:法拉第效率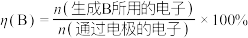
______ 。
④该环境下,测得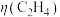 可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是______ mol。
(1)用烃类热裂解法制乙烯是乙烯工业化生产的开端。
①乙烷高温裂解制备乙烯(反应Ⅰ)的化学方程式是
②在裂解过程中伴随反应Ⅱ:
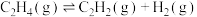 ,在高温下缩短
,在高温下缩短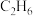 在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ
在反应器中的停留时间可提高乙烯的获取率,由此判断反应速率:反应Ⅰ(2)乙炔选择性加氢制乙烯是石油化工领域重要的发展阶段。
以钯(Pd)为催化剂可有效提高乙烯产率,在催化剂表面的反应机理如下图所示(吸附在催化剂表面的粒子用*标注)。
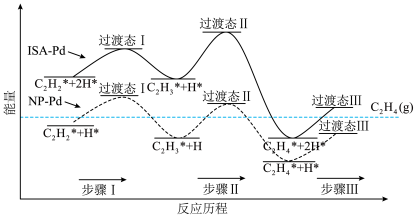
a.NP-Pd催化反应过程中步骤Ⅰ为放热反应
b.ISA-Pd催化反应过程中步骤Ⅱ为决速步骤
c.两种催化剂均能降低总反应的反应热
②吸附态乙烯(
 )脱离催化剂表面,可得到
)脱离催化剂表面,可得到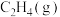 ,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制
,如未及时脱附,易在催化剂表面继续氢化经过渡态Ⅲ后而形成乙烷。制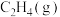 选择性较好的催化剂是
选择性较好的催化剂是(3)以
 为原料用不同的方法制乙烯有助于实现碳中和。
为原料用不同的方法制乙烯有助于实现碳中和。I.
 干气重整制乙烯。下图是2种投料比[
干气重整制乙烯。下图是2种投料比[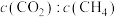 ,分别为1:1、2:1]下,反应温度对
,分别为1:1、2:1]下,反应温度对 平衡转化率影响的曲线。
平衡转化率影响的曲线。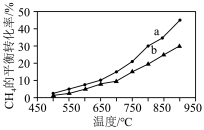
②当曲线a、b对应的投料比达到相同的
 平衡转化率时,对应的反应温度与投料比的关系是
平衡转化率时,对应的反应温度与投料比的关系是Ⅱ.双金属串联催化剂电催化
 制乙烯,装置示意图如图所示。
制乙烯,装置示意图如图所示。已知:法拉第效率
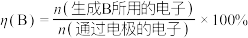
④该环境下,测得
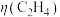 可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
可达50%,若电路中通过1.2mol电子时,则产生乙烯的物质的量是
您最近一年使用:0次




