名校
解题方法
1 . 某小组同学探究盐对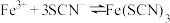 平衡体系的影响。
平衡体系的影响。
实验Ⅰ:探究KCl对 和
和 平衡体系的影响
平衡体系的影响
将等体积、低浓度的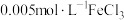 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和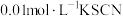 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
② 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。
(1)稀盐酸酸化 溶液的目的是
溶液的目的是___________ 。采用浓度较低的 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免___________ (填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向___________ (填“正”或“逆”)反应方向移动。
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。
(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
①上述实验可证明盐效应影响了 和
和 平衡体系的是
平衡体系的是___________ (填字母序号)。
a.1和2 b.1和3 c.1和4
②选择实验___________ (填序号)可得出结论: 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。
(4)取等体积的溶液a继续进行实验,结果如下表。
上述实验可证明副反应影响了 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:___________ 。
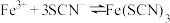 平衡体系的影响。
平衡体系的影响。实验Ⅰ:探究KCl对
 和
和 平衡体系的影响
平衡体系的影响将等体积、低浓度的
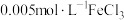 溶液(已用稀盐酸酸化)和
溶液(已用稀盐酸酸化)和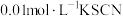 溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
溶液混合,静置至体系达平衡,得红色浴液a.各取3mL溶液a放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②
 在水溶液中由于水解而显黄色;
在水溶液中由于水解而显黄色; 溶液中存在
溶液中存在 (黄色)。
(黄色)。(1)稀盐酸酸化
 溶液的目的是
溶液的目的是 溶液制备
溶液制备 和
和 平衡体系,是为了避免
平衡体系,是为了避免(2)从实验结果来看,KCl溶液确实对
 和
和 平衡体系有影响,且随着KCl浓度增大,
平衡体系有影响,且随着KCl浓度增大, 平衡向
平衡向同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使
 和
和 平衡状态因盐效应而发生变化。
平衡状态因盐效应而发生变化。原因2:溶液中存在副反应
 ,离子浓度发生变化,导致
,离子浓度发生变化,导致 和
和 平衡状态发生变化。
平衡状态发生变化。(3)基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
| 序号 | 加入少量盐 | 溶液颜色 |
| 1 | 无 | 红色 |
| 2 | KCl | 变浅 |
| 3 |  | 略变浅 |
| 4 | NaCl | 变浅程度较大 |
 和
和 平衡体系的是
平衡体系的是a.1和2 b.1和3 c.1和4
②选择实验
 的盐效应弱于
的盐效应弱于 的盐效应。
的盐效应。(4)取等体积的溶液a继续进行实验,结果如下表。
| 序号 | 加入溶液 | 溶液颜色 |
| 5 | 1mL浓盐酸 | 明显变浅,溶液偏黄 |
| 6 | 1mL去离子水 | 略变浅 |
 和
和 平衡体系,结合实验现象及化学用语分析副反应对
平衡体系,结合实验现象及化学用语分析副反应对 和
和 平衡体系有影响的原因:
平衡体系有影响的原因:
您最近一年使用:0次
2023-04-20更新
|
117次组卷
|
4卷引用:河南省郑州市宇华实验学校2023-2024学年高二下学期开学考试化学试题
解题方法
2 . 已知 为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
(1)配制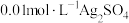 溶液和
溶液和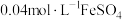 溶液。
溶液。
 基态核外电子排布式为
基态核外电子排布式为_______ ,实验中所需的玻璃仪器有容量瓶、量筒和_______ 。(从下图中选择,写出名称)
将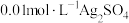 溶液与
溶液与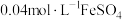 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
①甲同学通过测定滤液中 浓度测得K。取
浓度测得K。取 滤液,用
滤液,用 标准溶液滴定滤液中
标准溶液滴定滤液中 ,至滴定终点时消耗
,至滴定终点时消耗 标准溶液
标准溶液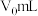 。滴定终点的现象为
。滴定终点的现象为_______ ,反应 的平衡常数
的平衡常数
_______ 。(用含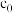 、
、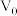 、V的计算式表示)
、V的计算式表示)
②乙同学通过测定滤液中 浓度测得K。取
浓度测得K。取 滤液,加入
滤液,加入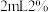 磺基水杨酸溶液,加入
磺基水杨酸溶液,加入 为9~11.5的缓冲溶液,测定吸光度。测得溶液中
为9~11.5的缓冲溶液,测定吸光度。测得溶液中 浓度为
浓度为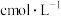 ,则
,则 的平衡常数
的平衡常数
_______ 。(用含c的计算式表示)
(3)该小组进一步研究常温下稀释对该平衡移动方向的影响。
用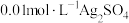 溶液和
溶液和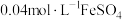 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。

_______ ,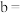
_______ 。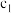 和
和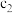 存在的关系是
存在的关系是_______ (用含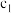 和
和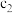 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
 为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。
为可逆反应,某小组设计实验测定该反应平衡常数并探究影响化学平衡移动的因素。(1)配制
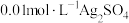 溶液和
溶液和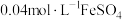 溶液。
溶液。 基态核外电子排布式为
基态核外电子排布式为
| 资料卡片 ⅰ. 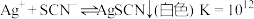 ; ;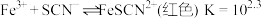 ⅱ.  为9~l1.5条件下 为9~l1.5条件下 和磺基水杨酸 和磺基水杨酸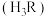 生成稳定的黄色络合物 生成稳定的黄色络合物 , , 可以通过测定吸光度得知其浓度。 可以通过测定吸光度得知其浓度。 |
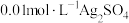 溶液与
溶液与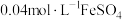 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液。(忽略反应引起的溶液体积变化)①甲同学通过测定滤液中
 浓度测得K。取
浓度测得K。取 滤液,用
滤液,用 标准溶液滴定滤液中
标准溶液滴定滤液中 ,至滴定终点时消耗
,至滴定终点时消耗 标准溶液
标准溶液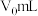 。滴定终点的现象为
。滴定终点的现象为 的平衡常数
的平衡常数
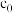 、
、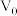 、V的计算式表示)
、V的计算式表示)②乙同学通过测定滤液中
 浓度测得K。取
浓度测得K。取 滤液,加入
滤液,加入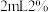 磺基水杨酸溶液,加入
磺基水杨酸溶液,加入 为9~11.5的缓冲溶液,测定吸光度。测得溶液中
为9~11.5的缓冲溶液,测定吸光度。测得溶液中 浓度为
浓度为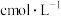 ,则
,则 的平衡常数
的平衡常数
(3)该小组进一步研究常温下稀释对该平衡移动方向的影响。
用
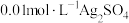 溶液和
溶液和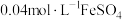 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。| 序号 | 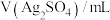 | 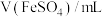 | 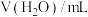 | 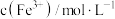 |
| Ⅰ | 10 | 10 | 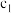 | |
| Ⅱ | 2 | a | b | 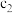 |

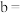
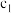 和
和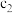 存在的关系是
存在的关系是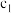 和
和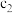 的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该平衡移动方向影响的证据。
您最近一年使用:0次
名校
3 . 某实验小组从电极反应角度探究银镜反应中物质氧化性和还原性的变化。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式_______ 。
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、_______ 。
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:_______ 。(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是_______ 。
(3)设计实验进一步验证。
①乙同学认为通过实验Ⅳ能证明“随c(Ag+)降低,Ag+氧化性减弱”,你认为是否合理并说明原因_______ 。
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是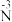 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是_______ 。
(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因_______ 。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
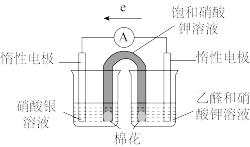
| 实验操作及现象: 实验Ⅰ.插入“饱和KNO3溶液”盐桥,电流表指针偏转; 实验Ⅱ.电流稳定后向右侧烧杯滴加NaOH溶液,指针偏转幅度增大; 实验Ⅲ.电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小 |
(3)设计实验进一步验证。
| 实验 | 实验操作 | 实验现象 |
| Ⅳ | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
| Ⅴ | 往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁 |
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是
 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因
您最近一年使用:0次
2022-04-02更新
|
1049次组卷
|
7卷引用:辽宁省葫芦岛市2024届高三一模化学试题
名校
4 . I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)⇌ (aq),某I2、KI混合溶液中,
(aq),某I2、KI混合溶液中, 的物质的量浓度c(
的物质的量浓度c( )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
 (aq),某I2、KI混合溶液中,
(aq),某I2、KI混合溶液中, 的物质的量浓度c(
的物质的量浓度c( )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是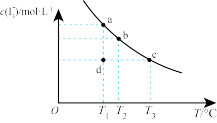
| A.温度为T1时,向该平衡体系中加入KI固体,平衡正同移动 |
B.I2(aq)+I-(aq)⇌ (aq)的△H<0 (aq)的△H<0 |
| C.若T1时,反应进行到状态d时,一定有v正>v逆 |
| D.状态a与状态b相比,状态b时I2的转化率更高 |
您最近一年使用:0次
2021-03-13更新
|
291次组卷
|
5卷引用:江苏省无锡市南菁高级中学实验班2023-2024学年高一下学期期中考试(化学)试卷
名校
5 . 各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A.CH3COOH CH3COO-+H+(忽略溶液体积变化) CH3COO-+H+(忽略溶液体积变化)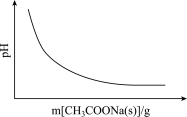 |
B.FeCl3+3KSCN Fe(SCN)3+3KCl(忽略溶液体积变化) Fe(SCN)3+3KCl(忽略溶液体积变化)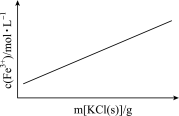 |
C.N2(g)+3H2(g)  2NH3(g)(恒温恒压) 2NH3(g)(恒温恒压) 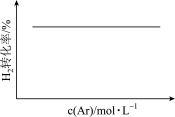 |
D.CH3OCH3(g)+3H2O(g)  6H2(g)+2CO2(g) △H>0(密闭容器,恒压) 6H2(g)+2CO2(g) △H>0(密闭容器,恒压)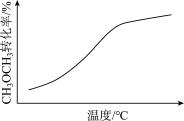 |
您最近一年使用:0次
2020-01-14更新
|
54次组卷
|
3卷引用:江苏省无锡市南菁高级中学实验班2023-2024学年高一下学期期中考试(化学)试卷



