名校
解题方法
1 . 以某石膏矿(主要成分是 ,含少量的
,含少量的 、
、 等杂质)为原料制备轻质
等杂质)为原料制备轻质 、
、 和
和 产品的工艺流程如下:
产品的工艺流程如下: 溶出。
溶出。
①“溶浸”时发生反应的化学方程式为______ 。
②“溶浸”时通常还加入一定量的氨水,加入氨水的作用是______ 。
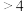 时,
时, 浸出率随着
浸出率随着 的增大而减小的原因是
的增大而减小的原因是______ 。
(2)将滤渣高温煅烧,冷却后用 溶液浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成轻质碳酸钙。
溶液浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成轻质碳酸钙。
①滤渣中含有的物质是______ 。
②在敞口容器中,用 溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中
溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中 增大的原因是
增大的原因是______ 。
(3)“盐化”过程中加入适量盐酸的目的是______ 。
(4) 、
、 的溶解度如图所示,“结晶”过程中先分离出
的溶解度如图所示,“结晶”过程中先分离出 晶体的方法是
晶体的方法是______ 。 的标准NaOH溶液滴定至终点,消耗NaOH溶液的体积19.40mL,已知:
的标准NaOH溶液滴定至终点,消耗NaOH溶液的体积19.40mL,已知: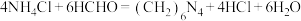 ,计算样品中
,计算样品中 的质量分数。
的质量分数。______ (写出计算过程)
 ,含少量的
,含少量的 、
、 等杂质)为原料制备轻质
等杂质)为原料制备轻质 、
、 和
和 产品的工艺流程如下:
产品的工艺流程如下: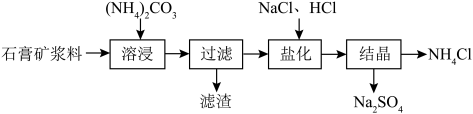
 溶出。
溶出。①“溶浸”时发生反应的化学方程式为
②“溶浸”时通常还加入一定量的氨水,加入氨水的作用是
③“溶浸”时, 的浸出率与
的浸出率与 的关系如图所示:
的关系如图所示: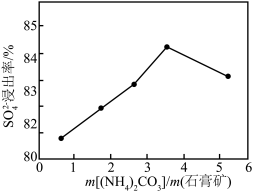

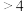 时,
时, 浸出率随着
浸出率随着 的增大而减小的原因是
的增大而减小的原因是(2)将滤渣高温煅烧,冷却后用
 溶液浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成轻质碳酸钙。
溶液浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成轻质碳酸钙。①滤渣中含有的物质是
②在敞口容器中,用
 溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中
溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中 增大的原因是
增大的原因是(3)“盐化”过程中加入适量盐酸的目的是
(4)
 、
、 的溶解度如图所示,“结晶”过程中先分离出
的溶解度如图所示,“结晶”过程中先分离出 晶体的方法是
晶体的方法是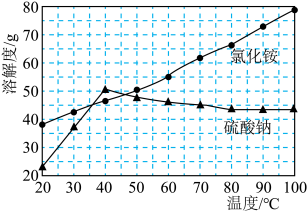
 的标准NaOH溶液滴定至终点,消耗NaOH溶液的体积19.40mL,已知:
的标准NaOH溶液滴定至终点,消耗NaOH溶液的体积19.40mL,已知: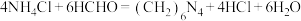 ,计算样品中
,计算样品中 的质量分数。
的质量分数。
您最近一年使用:0次
名校
解题方法
2 . 1-溴丙烷(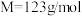 )是一种重要的有机合成中间体。已知1-溴丙烷常温下是一种无色油状液体、密度为
)是一种重要的有机合成中间体。已知1-溴丙烷常温下是一种无色油状液体、密度为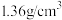 ,沸点为
,沸点为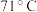 。实验室制备少量1-溴丙烷的主要步骤如下:
。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、 正丙醇及
正丙醇及 水,冰水冷却下缓慢加入
水,冰水冷却下缓慢加入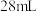 浓
浓 ,冷却至室温,搅拌下加入
,冷却至室温,搅拌下加入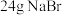 ;
;
步骤2:如图所示搭建实验装置,缓慢加热至反应进行完全;
步骤3:将馏出液转入分液漏斗,分出有机相(略带橙色);
步骤4:将有机相转入分液漏斗,进一步提纯得1-溴丙烷。
(1)仪器A的名称是__________ ,冷凝管的进水口为__________ (填“a”或“b”)。
(2)步骤1中加入搅拌磁子的目的是搅拌和__________ 。
(3)写出步骤2中生成1-溴丙烷的化学方程式__________ 。
(4)反应时生成的主要有机副产品有2-溴丙烷和__________ 、__________ 。
(5)步骤2中看到__________ 现象时说明反应已进行完全。
(6)步骤4中可选用如下操作进行提纯:
①用蒸馏水洗涤并分液、②用 溶液洗涤并分液、③用无水
溶液洗涤并分液、③用无水 干燥、④用浓
干燥、④用浓 干燥、⑤蒸馏、⑥重结晶、⑦过滤
干燥、⑤蒸馏、⑥重结晶、⑦过滤
正确的操作步骤为__________ (填序号,请选择合适的操作进行排序,可以重复使用)。
(7)步骤4中提纯得到1-溴丙烷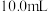 ,则本实验的产率为
,则本实验的产率为__________ (保留一位小数)。
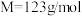 )是一种重要的有机合成中间体。已知1-溴丙烷常温下是一种无色油状液体、密度为
)是一种重要的有机合成中间体。已知1-溴丙烷常温下是一种无色油状液体、密度为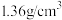 ,沸点为
,沸点为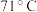 。实验室制备少量1-溴丙烷的主要步骤如下:
。实验室制备少量1-溴丙烷的主要步骤如下:步骤1:在仪器A中加入搅拌磁子、
 正丙醇及
正丙醇及 水,冰水冷却下缓慢加入
水,冰水冷却下缓慢加入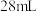 浓
浓 ,冷却至室温,搅拌下加入
,冷却至室温,搅拌下加入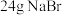 ;
;步骤2:如图所示搭建实验装置,缓慢加热至反应进行完全;
步骤3:将馏出液转入分液漏斗,分出有机相(略带橙色);
步骤4:将有机相转入分液漏斗,进一步提纯得1-溴丙烷。
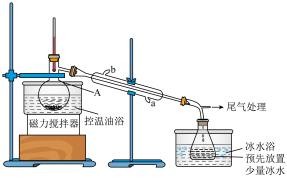
(1)仪器A的名称是
(2)步骤1中加入搅拌磁子的目的是搅拌和
(3)写出步骤2中生成1-溴丙烷的化学方程式
(4)反应时生成的主要有机副产品有2-溴丙烷和
(5)步骤2中看到
(6)步骤4中可选用如下操作进行提纯:
①用蒸馏水洗涤并分液、②用
 溶液洗涤并分液、③用无水
溶液洗涤并分液、③用无水 干燥、④用浓
干燥、④用浓 干燥、⑤蒸馏、⑥重结晶、⑦过滤
干燥、⑤蒸馏、⑥重结晶、⑦过滤正确的操作步骤为
(7)步骤4中提纯得到1-溴丙烷
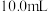 ,则本实验的产率为
,则本实验的产率为
您最近一年使用:0次
名校
解题方法
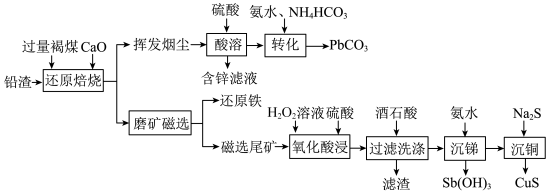
3 . 铅渣由多种氧化物及它们相互结合而形成的化合物、固溶体、共晶混合物所组成。对铅渣进行综合利用,回收其中的有价金属(Cu、Fe、Pb、Zn、Sb)的部分工艺流程如下:________________ 。
(2)挥发烟尘中的主要氧化物为PbO—ZnO2。
①区分挥发烟尘中的氧化物是晶体还是非晶体的最可靠的科学方法为__________ (填选项)。
A.核磁共振氢谱 B.X射线衍射 C.质谱法
②“转化”过程中,发生反应的化学方程式为________________ 。
(3)“氧化酸浸”过程中,若将物质的量为3mol的Cu—Sb合金(其中Cu与Sb物质的量之比为1∶2)氧化,至少需要H2O2的物质的量为________ mol。
(4)“过滤洗涤”过程中,加入酒石酸(表示为C4H6O6)发生如下配位反应:
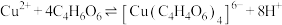 、
、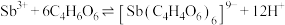
①上述两个配合物中,提供空轨道的元素为____________ (填元素符号)。
②滤渣的主要成分是_____________________ 。
③“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为______________________ 。
(2)挥发烟尘中的主要氧化物为PbO—ZnO2。
①区分挥发烟尘中的氧化物是晶体还是非晶体的最可靠的科学方法为
A.核磁共振氢谱 B.X射线衍射 C.质谱法
②“转化”过程中,发生反应的化学方程式为
(3)“氧化酸浸”过程中,若将物质的量为3mol的Cu—Sb合金(其中Cu与Sb物质的量之比为1∶2)氧化,至少需要H2O2的物质的量为
(4)“过滤洗涤”过程中,加入酒石酸(表示为C4H6O6)发生如下配位反应:
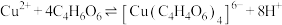 、
、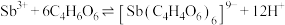
①上述两个配合物中,提供空轨道的元素为
②滤渣的主要成分是
③“过滤洗涤”时,用酒石酸稀溶液洗涤滤渣而不用水。用酒石酸稀溶液洗涤可减少金属离子的损失,原因为
您最近一年使用:0次
名校
4 . 下列类推结论中正确的是
| A.含Fe3O4可写成FeO·Fe2O3,Pb3O4也可写成PbO·Pb2O3 |
| B.浓硫酸可以干燥氯化氢气体,则也能干燥氟化氢气体 |
C. 与 与 在溶液中可发生相互促进的水解反应生成沉淀和气体, 在溶液中可发生相互促进的水解反应生成沉淀和气体, 与 与 也是如此 也是如此 |
| D.FeS和稀硫酸反应生成硫化氢,CuS也可以和稀硫酸反应生成硫化氢 |
您最近一年使用:0次
名校
5 . 标准状况下,将SO2和Cl2组成的混合气体amol通入200mL Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是
Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是
 Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是
Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则a的数值可能是| A.0.06 | B.0.07 | C.0.08 | D.0.09 |
您最近一年使用:0次
名校
解题方法
6 . 2024年上海国际碳中和技术博览会以“中和科技、碳素未来”为主题,重点聚焦二氧化碳的捕捉、利用与封存(CCUS)等问题。回答下列问题:
Ⅰ. 是典型的温室气体,Sabatier反应可实现
是典型的温室气体,Sabatier反应可实现 转化为甲烷,实现
转化为甲烷,实现 的资源化利用。合成
的资源化利用。合成 过程中涉及如下反应:
过程中涉及如下反应:
甲烷化反应(主反应):①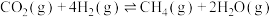

逆变换反应(副反应):②

(1)反应③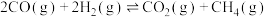

___________ ,该反应在___________ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)下列叙述中能说明反应①达到平衡状态的是___________ (填字母)。
A.断裂4mol 的同时断裂1mol
的同时断裂1mol 
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.
E.绝热恒容条件下, 不再变化
不再变化
(3)科研小组按 进行投料,下面探究影响
进行投料,下面探究影响 选择性的一些因素。
选择性的一些因素。
①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是___________ (填“曲线1”“曲线2”或“曲线3”)。曲线1和曲线3交叉点处 的平衡分压为
的平衡分压为___________ MPa(该空忽略副反应逆变换反应)。
反应a:

反应b: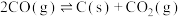

反应c: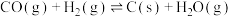

由表中数据可知,积碳反应主要由反应___________ 引起(填“a”“b”或“c”)。
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol 和6mol
和6mol  ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
___________ 。(该反应标准平衡常数的表达式为 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,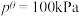 )
)
Ⅰ.
 是典型的温室气体,Sabatier反应可实现
是典型的温室气体,Sabatier反应可实现 转化为甲烷,实现
转化为甲烷,实现 的资源化利用。合成
的资源化利用。合成 过程中涉及如下反应:
过程中涉及如下反应:甲烷化反应(主反应):①
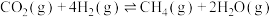

逆变换反应(副反应):②


(1)反应③
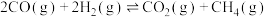

(2)下列叙述中能说明反应①达到平衡状态的是
A.断裂4mol
 的同时断裂1mol
的同时断裂1mol 
B.恒温恒容条件下,体系压强不再变化
C.恒温恒容条件下,气体的密度不再变化
D.

E.绝热恒容条件下,
 不再变化
不再变化(3)科研小组按
 进行投料,下面探究影响
进行投料,下面探究影响 选择性的一些因素。
选择性的一些因素。①若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图所示。图中表示
 的物质的量分数随温度变化的曲线是
的物质的量分数随温度变化的曲线是 的平衡分压为
的平衡分压为
| 温度℃ |  |  |  |
| 800 | 21.60 | 0.136 | 0.133 |
| 850 | 33.94 | 0.058 | 0.067 |
| 900 | 51.38 | 0.027 | 0.036 |


反应b:
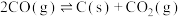

反应c:
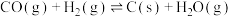

由表中数据可知,积碳反应主要由反应
Ⅱ.完成下列问题
(4)一定条件下,向4L恒容密闭容器中充入2mol
 和6mol
和6mol  ,发生反应
,发生反应 。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
。已知容器内起始压强为240kPa,反应达平衡时容器内压强为150kPa,该温度下反应的标准平衡常数
 ,其中p为分压,分压=总压×物质的量分数,
,其中p为分压,分压=总压×物质的量分数,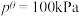 )
)
您最近一年使用:0次
名校
解题方法
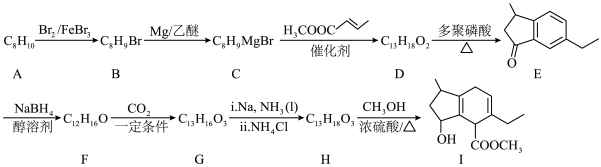
7 . 有机化合物Ⅰ是治疗头风、痈肿和皮肤麻痹等疾病药物的重要中间体,其合成路线如下:
(1)A的结构简式为________________ ,B的名称为________________ ;
(2) 的化学方程式为
的化学方程式为________________ ;
(3)I中含氧官能团的名称为________________ ;
(4) 的反应类型为
的反应类型为________________ ;
(5)鉴别F和G可选用的试剂为________(填选项字母);
(6)有机物W是D的同系物,且具有以下特征:
i.比D少4个碳原子; ⅱ.含甲基且能发生银镜反应
符合上述条件的W有________ 种(不考虑立体异构);其中核磁共振氢谱峰面积之比为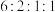 的W的结构简式为
的W的结构简式为________ 。
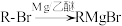
ⅱ.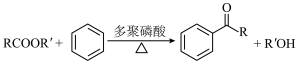
ⅲ.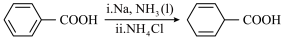
(1)A的结构简式为
(2)
 的化学方程式为
的化学方程式为(3)I中含氧官能团的名称为
(4)
 的反应类型为
的反应类型为(5)鉴别F和G可选用的试剂为________(填选项字母);
A. 溶液 溶液 | B.溴水 | C.酸性高锰酸钾溶液 | D. 溶液 溶液 |
(6)有机物W是D的同系物,且具有以下特征:
i.比D少4个碳原子; ⅱ.含甲基且能发生银镜反应
符合上述条件的W有
 的W的结构简式为
的W的结构简式为
您最近一年使用:0次
昨日更新
|
173次组卷
|
2卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷
名校
8 . 温室气体 和
和 对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
Ⅰ. 工业上利用 和
和 催化重整制取
催化重整制取 和CO,主要反应为
和CO,主要反应为
反应①: CH4(g)+ CO2(g) 2CO(g) + 2H2(g)
2CO(g) + 2H2(g) 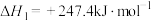
过程中还发生三个副反应:
反应②:H2(g)+ CO2(g) CO(g) + H2O (g)
CO(g) + H2O (g) 
反应③:2 CO(g) CO2 (g) + C (s)
CO2 (g) + C (s) 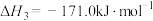
反应④:CH4(g) 2 H2 (g) + C (s)
2 H2 (g) + C (s) 
将 与
与 (体积比为1∶1)的混合气体以一定流速通过催化剂,产物中
(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中 与CO的物质的量之比、
与CO的物质的量之比、 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:
_______ 。
(2)500℃时, 比较小,此时发生的副反应以
比较小,此时发生的副反应以_______ (选填②、③、④中一种)为主。升高温度,产物中 与CO的物质的量之比增大的原因是
与CO的物质的量之比增大的原因是_______ 。
Ⅱ. 温室气体CH4可以和H2S在一定条件下发生反应:CH4(g)+2H2S(g) CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:_______ 。
(4)N点对应温度下,该反应的KP =_______ (MPa)2 (保留两位有效数字)
Ⅲ.用光电化学法将 还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:
还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示: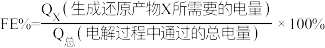 ,其中,
,其中, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
(5)当电解电压为u1 V时,阴极生成HCHO的电极反应式为_______ 。
(6)当电解电压为u2 V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为_______ 。
 和
和 对环境危害大,在工业生产中尽量将它们转化为可用的原材料。
对环境危害大,在工业生产中尽量将它们转化为可用的原材料。Ⅰ. 工业上利用
 和
和 催化重整制取
催化重整制取 和CO,主要反应为
和CO,主要反应为反应①: CH4(g)+ CO2(g)
 2CO(g) + 2H2(g)
2CO(g) + 2H2(g) 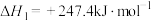
过程中还发生三个副反应:
反应②:H2(g)+ CO2(g)
 CO(g) + H2O (g)
CO(g) + H2O (g) 
反应③:2 CO(g)
 CO2 (g) + C (s)
CO2 (g) + C (s) 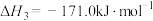
反应④:CH4(g)
 2 H2 (g) + C (s)
2 H2 (g) + C (s) 
将
 与
与 (体积比为1∶1)的混合气体以一定流速通过催化剂,产物中
(体积比为1∶1)的混合气体以一定流速通过催化剂,产物中 与CO的物质的量之比、
与CO的物质的量之比、 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示: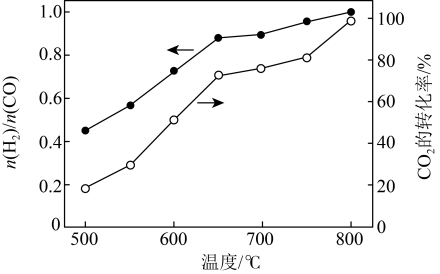

(2)500℃时,
 比较小,此时发生的副反应以
比较小,此时发生的副反应以 与CO的物质的量之比增大的原因是
与CO的物质的量之比增大的原因是Ⅱ. 温室气体CH4可以和H2S在一定条件下发生反应:CH4(g)+2H2S(g)
 CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S)∶n(CH4)=2∶1.0.1 MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示: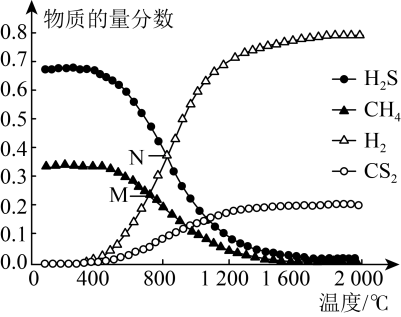
(4)N点对应温度下,该反应的KP =
Ⅲ.用光电化学法将
 还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:
还原为有机物实现碳资源的再生利用,其装置如左图所示,其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示: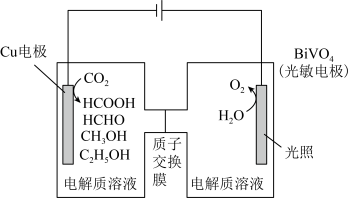
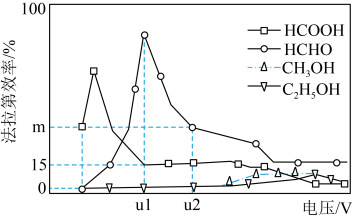
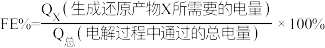 ,其中,
,其中, ,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。
,n表示电解生成还原产物X所转移电子的物质的量,F表示法拉第常数。(5)当电解电压为u1 V时,阴极生成HCHO的电极反应式为
(6)当电解电压为u2 V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为
您最近一年使用:0次
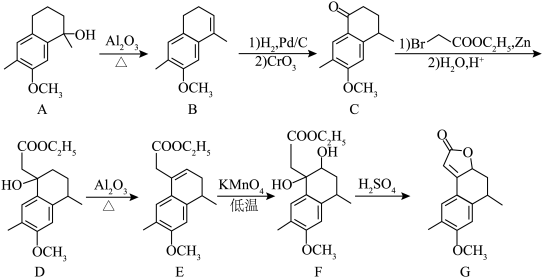
9 . 化合物G是合成药物的重要中间体,其合成路线如下图所示。
(1)A→B的反应类型是___________ 。
(2)B→C的过程中,氧化得到的官能团是___________ (填名称)。
(3)F中有___________ 个手性碳原子。
(4)F→G的化学方程式为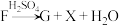 ,则X的结构简式为
,则X的结构简式为___________ 。
(5)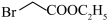 的同分异构体中,与其具有相同官能团的有
的同分异构体中,与其具有相同官能团的有___________ 种(不考虑立体异构和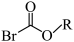 结构);其中核磁共振氢谱有两组峰,且峰面积之比为
结构);其中核磁共振氢谱有两组峰,且峰面积之比为 的结构简式为
的结构简式为___________ 。
(6)以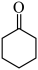 、乙醇为含碳原料,利用上述合成路线中“C→”的原理,合成化合物H(
、乙醇为含碳原料,利用上述合成路线中“C→”的原理,合成化合物H(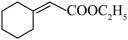 )。
)。___________ 。
②最后一步转化中,反应物的结构简式为___________ 。
(1)A→B的反应类型是
(2)B→C的过程中,氧化得到的官能团是
(3)F中有
(4)F→G的化学方程式为
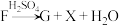 ,则X的结构简式为
,则X的结构简式为(5)
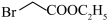 的同分异构体中,与其具有相同官能团的有
的同分异构体中,与其具有相同官能团的有 结构);其中核磁共振氢谱有两组峰,且峰面积之比为
结构);其中核磁共振氢谱有两组峰,且峰面积之比为 的结构简式为
的结构简式为(6)以
 、乙醇为含碳原料,利用上述合成路线中“C→”的原理,合成化合物H(
、乙醇为含碳原料,利用上述合成路线中“C→”的原理,合成化合物H(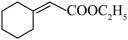 )。
)。已知:RCH2COOH

②最后一步转化中,反应物的结构简式为
您最近一年使用:0次
名校
解题方法
10 . 苯乙烯作为一种重要的基础有机化工原料,广泛用于合成塑料和橡胶。工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应Ⅰ: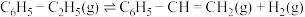

(1)近期有科技工作者结合是实验与计算机模拟结果,研究了乙苯在催化剂表面脱氢制苯乙烯的反应,其历程如下图所示(吸附在催化剂表面的物种用 标注):
标注):
___________  (计算结果保留整数)。
(计算结果保留整数)。
②依据上述反应历程,推测乙苯脱氢反应产生的副产物可能是___________ (填结构简式)
(2)在 下,乙苯直接脱氢反应的
下,乙苯直接脱氢反应的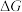 和
和 随温度的变化如图所示。
随温度的变化如图所示。___________ (选填“能”或“不能”)自发。
② 随温度的变化曲线为
随温度的变化曲线为___________ (选填“a”或“b”)。
(3)在某温度、 下,向反应器中充入
下,向反应器中充入 气态乙苯和
气态乙苯和 发生反应Ⅰ,其平衡转化率为
发生反应Ⅰ,其平衡转化率为 ,则乙苯脱氢反应的压强平衡常数
,则乙苯脱氢反应的压强平衡常数
___________ (计算时忽略副反应)。
(4)工业上还可以利用 氧化乙苯制乙烯,其原理为:反应Ⅱ:
氧化乙苯制乙烯,其原理为:反应Ⅱ: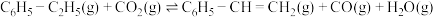
 ,在相同反应条件下,工业上可采用
,在相同反应条件下,工业上可采用 替代水蒸气进行乙苯脱氢反应,已知
替代水蒸气进行乙苯脱氢反应,已知 ;则
;则 代替水蒸气参与反应的优点有
代替水蒸气参与反应的优点有___________ 。
A.降低反应的能耗 B.乙苯转化率更高
C.提高了反应速率 D.提高了产物选择性
(5)苯乙烯被酸性高锰酸钾溶液充分氧化后的产物是___________ 和___________ (填名称)。
反应Ⅰ:
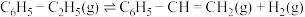

(1)近期有科技工作者结合是实验与计算机模拟结果,研究了乙苯在催化剂表面脱氢制苯乙烯的反应,其历程如下图所示(吸附在催化剂表面的物种用
 标注):
标注):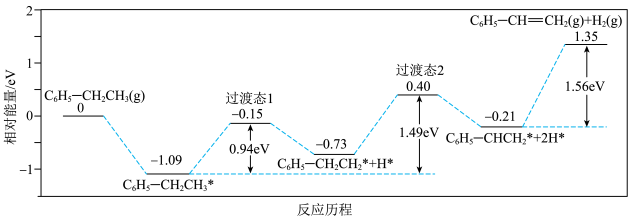

 (计算结果保留整数)。
(计算结果保留整数)。②依据上述反应历程,推测乙苯脱氢反应产生的副产物可能是
(2)在
 下,乙苯直接脱氢反应的
下,乙苯直接脱氢反应的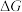 和
和 随温度的变化如图所示。
随温度的变化如图所示。
②
 随温度的变化曲线为
随温度的变化曲线为(3)在某温度、
 下,向反应器中充入
下,向反应器中充入 气态乙苯和
气态乙苯和 发生反应Ⅰ,其平衡转化率为
发生反应Ⅰ,其平衡转化率为 ,则乙苯脱氢反应的压强平衡常数
,则乙苯脱氢反应的压强平衡常数
(4)工业上还可以利用
 氧化乙苯制乙烯,其原理为:反应Ⅱ:
氧化乙苯制乙烯,其原理为:反应Ⅱ:
 ,在相同反应条件下,工业上可采用
,在相同反应条件下,工业上可采用 替代水蒸气进行乙苯脱氢反应,已知
替代水蒸气进行乙苯脱氢反应,已知 ;则
;则 代替水蒸气参与反应的优点有
代替水蒸气参与反应的优点有A.降低反应的能耗 B.乙苯转化率更高
C.提高了反应速率 D.提高了产物选择性
(5)苯乙烯被酸性高锰酸钾溶液充分氧化后的产物是
您最近一年使用:0次



