名校
解题方法
1 . 苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
实验步骤:
①在下图装置中加入1.5mL(约0.014mol)甲苯、100mL水和4.8g(约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流。 溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后对合并后的溶液进行处理。
溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后对合并后的溶液进行处理。
③将析出的苯甲酸过滤,用少量冷水洗涤后于热水浴上干燥。称量,粗产品为1.0g。
④纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,用0.01000 的KOH标准溶液滴定,三次滴定平均消耗17.00mL的KOH标准溶液。
的KOH标准溶液滴定,三次滴定平均消耗17.00mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为_______(填标号)。
(2)仪器A的名称为_______ ,当加热回流至观察到出现_______ 现象时,可停止反应。
(3)对合并后溶液进行处理的实验操作为_______ 。
(4)加入适量饱和 溶液的目的是
溶液的目的是_______ ;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理_______ 。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是_______ 。
(6)本实验制备的苯甲酸的纯度为_______ ;据此估算本实验中苯甲酸的产率最接近于_______ (填标号)。
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中_______ 的方法提纯。
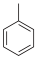 +KMnO4→
+KMnO4→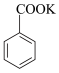 + MnO2;
+ MnO2;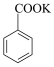 + HCl
+ HCl 
 + KCl。
+ KCl。
名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g/mL) | 溶解性 |
甲苯 | 92 | −95 | 110.6 | 0.867 | 不溶于水,易溶于乙醇 |
苯甲酸 | 122 | 122.4 (100℃左右开始升华) | 248 | —— | 微溶于冷水,易溶于乙醇、热水 |
①在下图装置中加入1.5mL(约0.014mol)甲苯、100mL水和4.8g(约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流。

 溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后对合并后的溶液进行处理。
溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后对合并后的溶液进行处理。③将析出的苯甲酸过滤,用少量冷水洗涤后于热水浴上干燥。称量,粗产品为1.0g。
④纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00mL溶液,用0.01000
 的KOH标准溶液滴定,三次滴定平均消耗17.00mL的KOH标准溶液。
的KOH标准溶液滴定,三次滴定平均消耗17.00mL的KOH标准溶液。回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为_______(填标号)。
| A.100mL | B.250mL | C.500mL | D.1000mL |
(2)仪器A的名称为
(3)对合并后溶液进行处理的实验操作为
(4)加入适量饱和
 溶液的目的是
溶液的目的是(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是
(6)本实验制备的苯甲酸的纯度为
A.70% B.60% C.50% D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中
您最近一年使用:0次
真题
解题方法
2 . 某小组采用如下实验流程制备 :
: 是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
请回答:
(1)如图为步骤I的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器A的名称是_______ ,判断步骤I反应结束的实验现象是_______ 。不正确 的是_______。
(3)所得粗产品呈浅棕黄色,小组成员认为其中混有碘单质,请设计实验方案验证_______ 。
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中 含量以确定纯度。滴定原理为:先用过量
含量以确定纯度。滴定原理为:先用过量 标准溶液沉淀
标准溶液沉淀 ,再以
,再以 标准溶液回滴剩余的
标准溶液回滴剩余的 。已知:
。已知:
①从下列选项中选择合适的操作补全测定步骤_______ 。
称取产品 ,用少量稀酸A溶解后转移至
,用少量稀酸A溶解后转移至 容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取
容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取 待测溶液加入锥形瓶→_______→_______→加入稀酸B→用
待测溶液加入锥形瓶→_______→_______→加入稀酸B→用 标准溶液滴定→_______→读数。
标准溶液滴定→_______→读数。
a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂 溶液
溶液
d.滴加指示剂硫酸铁铵 溶液
溶液
e.准确移取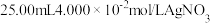 标准溶液加入锥形瓶
标准溶液加入锥形瓶
f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
②加入稀酸B的作用是_______ 。
③三次滴定消耗 标准溶液的平均体积为
标准溶液的平均体积为 ,则产品纯度为
,则产品纯度为_______ 。
 :
:
 是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。请回答:
(1)如图为步骤I的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器A的名称是

| A.步骤I中,反应物和溶剂在使用前除水 |
| B.步骤I中,若控温加热器发生故障,改用酒精灯(配石棉网)加热 |
| C.步骤Ⅲ中,在通风橱中浓缩至蒸发皿内出现晶膜 |
| D.步骤Ⅳ中,使用冷的正己烷洗涤 |
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中
 含量以确定纯度。滴定原理为:先用过量
含量以确定纯度。滴定原理为:先用过量 标准溶液沉淀
标准溶液沉淀 ,再以
,再以 标准溶液回滴剩余的
标准溶液回滴剩余的 。已知:
。已知:| 难溶电解质 |  (黄色) (黄色) |  (白色) (白色) |  (红色) (红色) |
溶度积常数 | 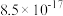 | 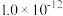 |  |
称取产品
 ,用少量稀酸A溶解后转移至
,用少量稀酸A溶解后转移至 容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取
容量瓶,加水定容得待测溶液。取滴定管检漏、水洗→_______→装液、赶气泡、调液面、读数→用移液管准确移取 待测溶液加入锥形瓶→_______→_______→加入稀酸B→用
待测溶液加入锥形瓶→_______→_______→加入稀酸B→用 标准溶液滴定→_______→读数。
标准溶液滴定→_______→读数。a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂
 溶液
溶液d.滴加指示剂硫酸铁铵
 溶液
溶液e.准确移取
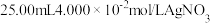 标准溶液加入锥形瓶
标准溶液加入锥形瓶f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
②加入稀酸B的作用是
③三次滴定消耗
 标准溶液的平均体积为
标准溶液的平均体积为 ,则产品纯度为
,则产品纯度为
您最近一年使用:0次
名校
3 . 工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物A等,其中A的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:_________ 。
(2)写出下列反应的反应类型:⑤_________ ,⑥_________ 。
(3)M与F互为同系物,分子中含5个碳原子,M的结构有_________ 种;M的其中一种结构含有3个-CH3,写出其结构简式_________ 。
(4)下列说法正确的是_________ 。
A.丙烯酸可能发生中和反应、取代反应、加成反应、氧化反应
B.聚丙烯酸能够使酸性高锰酸钾溶液褪色
C.有机物C与丙烯酸属于同系物
(5)有机物B、C反应生成乙酸乙酯的反应在实验室中可在如图装置中进行。_________ (化学式),试管乙试剂中的作用是_______________ 。
②该反应的化学方程式是_______________ 。
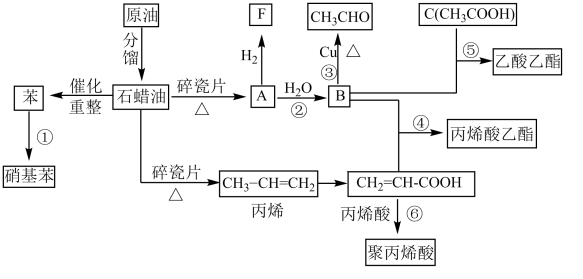
(2)写出下列反应的反应类型:⑤
(3)M与F互为同系物,分子中含5个碳原子,M的结构有
(4)下列说法正确的是
A.丙烯酸可能发生中和反应、取代反应、加成反应、氧化反应
B.聚丙烯酸能够使酸性高锰酸钾溶液褪色
C.有机物C与丙烯酸属于同系物
(5)有机物B、C反应生成乙酸乙酯的反应在实验室中可在如图装置中进行。
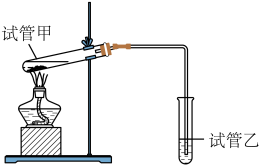
②该反应的化学方程式是
您最近一年使用:0次
4 . 用如图所示装置进行中和反应反应热的测定实验,请回答下列问题:_________ 。装置中隔热层的作用是_________ 。
(2)取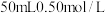 稀盐酸与
稀盐酸与 溶液在简易量热计中进行中和反应,三次实验温度平均升高
溶液在简易量热计中进行中和反应,三次实验温度平均升高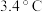 ,已知中和后生成的溶液的比热容为
,已知中和后生成的溶液的比热容为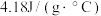 ,溶液的密度均为
,溶液的密度均为 ,通过计算可得生成
,通过计算可得生成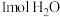 时放出的热量为
时放出的热量为_________  。(保留小数点后一位)
。(保留小数点后一位)
(3)上述实验数值结果与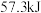 有偏差,产生此偏差的原因可能是
有偏差,产生此偏差的原因可能是_________ (填字母)。
a.实验装置保温、隔热效果差
b.用温度计测定 溶液起始温度后直接测定稀盐酸的温度
溶液起始温度后直接测定稀盐酸的温度
c.一次性把 溶液倒入盛有盐酸的简易量热计中
溶液倒入盛有盐酸的简易量热计中
(4)若将各含 溶质的
溶质的 稀溶液、
稀溶液、 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为
稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为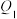 、
、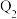 、
、 ,则
,则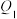 、
、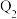 、
、 的关系为
的关系为______________ 。
(5)实验中若改用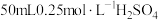 溶液和
溶液和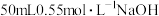 溶液进行反应,与上述实验相比,通过计算可得生成
溶液进行反应,与上述实验相比,通过计算可得生成 时所放出的热量
时所放出的热量_________ (填“相等”或“不相等”)。若用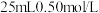 醋酸代替
醋酸代替 溶液进行上述实验,测得反应前后温度的变化值会
溶液进行上述实验,测得反应前后温度的变化值会_________ (填“偏大”“偏小”或“不受影响”)。

(2)取
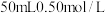 稀盐酸与
稀盐酸与 溶液在简易量热计中进行中和反应,三次实验温度平均升高
溶液在简易量热计中进行中和反应,三次实验温度平均升高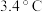 ,已知中和后生成的溶液的比热容为
,已知中和后生成的溶液的比热容为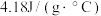 ,溶液的密度均为
,溶液的密度均为 ,通过计算可得生成
,通过计算可得生成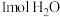 时放出的热量为
时放出的热量为 。(保留小数点后一位)
。(保留小数点后一位)(3)上述实验数值结果与
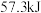 有偏差,产生此偏差的原因可能是
有偏差,产生此偏差的原因可能是a.实验装置保温、隔热效果差
b.用温度计测定
 溶液起始温度后直接测定稀盐酸的温度
溶液起始温度后直接测定稀盐酸的温度c.一次性把
 溶液倒入盛有盐酸的简易量热计中
溶液倒入盛有盐酸的简易量热计中(4)若将各含
 溶质的
溶质的 稀溶液、
稀溶液、 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为
稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为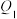 、
、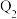 、
、 ,则
,则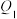 、
、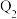 、
、 的关系为
的关系为(5)实验中若改用
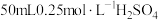 溶液和
溶液和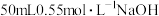 溶液进行反应,与上述实验相比,通过计算可得生成
溶液进行反应,与上述实验相比,通过计算可得生成 时所放出的热量
时所放出的热量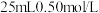 醋酸代替
醋酸代替 溶液进行上述实验,测得反应前后温度的变化值会
溶液进行上述实验,测得反应前后温度的变化值会
您最近一年使用:0次
名校
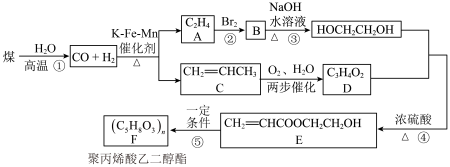
5 . 聚丙烯酸乙二醇酯是一种良好的水溶性涂料。工业上以煤为原料可设计合成路线如下:
(1)C的名称为___________ ,E中含氧官能团名称为___________ 。
(2)③的反应类型为___________ 。
(3)反应④的化学方程式为___________ 。
(4)反应⑤的化学方程式为___________ 。
(5)下列对图中有关物质的叙述正确的是___________ (填标号)。
a.煤的干馏是指在空气中加强热使其分解
b.化合物A和C互为同系物
c.化合物C中最多有7个原子在同一平面上
查阅资料获得信息: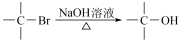
(1)C的名称为
(2)③的反应类型为
(3)反应④的化学方程式为
(4)反应⑤的化学方程式为
(5)下列对图中有关物质的叙述正确的是
a.煤的干馏是指在空气中加强热使其分解
b.化合物A和C互为同系物
c.化合物C中最多有7个原子在同一平面上
您最近一年使用:0次
名校
解题方法
6 . 探究固体A(仅含3种元素)的组成和性质,设计并完成了如图所示实验:
(1)A的组成元素为O及___________ (填元素符号)。
(2)C的化学式为___________ 。
(3)E→F的离子方程式为___________ 。
(4)下列说法正确的是___________。
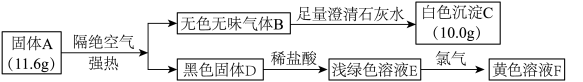
(1)A的组成元素为O及
(2)C的化学式为
(3)E→F的离子方程式为
(4)下列说法正确的是___________。
| A.固体A中金属原子和O原子物质的量之比为1:3 |
| B.黑色固体D可用作磁性材料 |
| C.将5mL1mol/LF溶液与5mL1mol/LNaOH溶液混合,可制得一种红褐色胶体 |
| D.检验E中金属阳离子的方法:先加KSCN溶液,再通少量Cl2 |
您最近一年使用:0次
名校
解题方法
7 . 以软锰矿(主要含有MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备KMnO4的工艺流程如图所示:
①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于_______ 区,核外电子占据最高能层的符号是_______ ,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用_______ “理论”解释。
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为_______ 。
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为_______ 。
(4)“除Ca、Mg”时,所得滤液中 =
=_______ 。
(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为_______ 。
②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为_______ 。
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为_______ (填“阴极”或“阳极”)。
②阳极的电极反应式为_______ 。

①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为
(4)“除Ca、Mg”时,所得滤液中
 =
=(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO
 )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为
②阳极的电极反应式为
您最近一年使用:0次
名校
8 . 二氯化二硫( )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)有关 的下列说法正确的是 。
的下列说法正确的是 。
(2)选用以下装置制取少量 (加热及夹持装置略):
(加热及夹持装置略):_____________________ 。
②装置连接顺序:A→__________ →D。
③B中玻璃纤维的作用是______________________ 。
④D中的最佳试剂是__________ (选填序号)。
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3) 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。_________ (填标号);
a. 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
 )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)有关
 的下列说法正确的是 。
的下列说法正确的是 。A. 中S-Cl键的键能大于S-S键的键能 中S-Cl键的键能大于S-S键的键能 | B.固态时 属于原子晶体 属于原子晶体 |
| C.第一电离能、电负性均为:Cl>S | D. 中既有极性键又有非极性键 中既有极性键又有非极性键 |
(2)选用以下装置制取少量
 (加热及夹持装置略):
(加热及夹持装置略):
②装置连接顺序:A→
③B中玻璃纤维的作用是
④D中的最佳试剂是
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3)
 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
a.
 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
您最近一年使用:0次
名校
9 . 有机物A的分子式为C4H8O2,其转化关系如图所示:_______ 。
(2)有机物A与NaOH溶液反应的化学方程式是_______ 。
(3)下列说法不正确的是_______。
(4)E→C的反应类型是_______ 。
(5)写出乙烯和C反应生成A的化学方程式_______ 。

(2)有机物A与NaOH溶液反应的化学方程式是
(3)下列说法不正确的是_______。
| A.B→C的反应属于加成反应 | B.等质量的A和E完全燃烧,消耗的O2的量相同 |
| C.可用银氨溶液鉴别D和E | D.C和D都可以和Na发生反应 |
(4)E→C的反应类型是
(5)写出乙烯和C反应生成A的化学方程式
您最近一年使用:0次
名校
10 . 碘及其化合物广泛用于医药、染料等方面。用沉淀滴定法快速测定NaI等碘化物溶液中 ,实验过程包括准备标准溶液和滴定待测溶液。
,实验过程包括准备标准溶液和滴定待测溶液。
一、准备标准溶液
I.准确称取 基准物
基准物 后,配制成
后,配制成 标准溶液,放在棕色试剂瓶中避光保存,备用。
标准溶液,放在棕色试剂瓶中避光保存,备用。
II.配制并标定 标准溶液,备用。
标准溶液,备用。
二、滴定的主要步骤
a.取待测NaI溶液 于锥形瓶中。
于锥形瓶中。
c.加入 溶液作指示剂。
溶液作指示剂。
d.用 溶液滴定过量的
溶液滴定过量的 ,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
f.数据处理。
(1)将称得的 配制成标准溶液,所使用的仪器不包括___________。
配制成标准溶液,所使用的仪器不包括___________。
(2)b和c两步操作是否可以颠倒___________ ,说明理由___________ 。
(3)当___________ 即达到滴定终点。消耗的 标准溶液平均体积为
标准溶液平均体积为___________  ,计算得
,计算得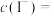
___________  ;在滴定管中装入
;在滴定管中装入 标准溶液的前一步,应进行的操作为
标准溶液的前一步,应进行的操作为___________ ;如不进行此步操作,对实验结果产生怎样的影响___________ 。
(4)若在配制 标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________ 。
 ,实验过程包括准备标准溶液和滴定待测溶液。
,实验过程包括准备标准溶液和滴定待测溶液。一、准备标准溶液
I.准确称取
 基准物
基准物 后,配制成
后,配制成 标准溶液,放在棕色试剂瓶中避光保存,备用。
标准溶液,放在棕色试剂瓶中避光保存,备用。II.配制并标定
 标准溶液,备用。
标准溶液,备用。二、滴定的主要步骤
a.取待测NaI溶液
 于锥形瓶中。
于锥形瓶中。c.加入
 溶液作指示剂。
溶液作指示剂。d.用
 溶液滴定过量的
溶液滴定过量的 ,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。e.重复上述操作两次。三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
消耗 标准溶液体积/mL 标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
(1)将称得的
 配制成标准溶液,所使用的仪器不包括___________。
配制成标准溶液,所使用的仪器不包括___________。| A.烧杯 | B.胶头滴管 | C.容量瓶 | D.量筒 |
(3)当
 标准溶液平均体积为
标准溶液平均体积为 ,计算得
,计算得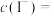
 ;在滴定管中装入
;在滴定管中装入 标准溶液的前一步,应进行的操作为
标准溶液的前一步,应进行的操作为(4)若在配制
 标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。| A.偏高 | B.偏低 | C.无影响 | D.无法判断 |
| A.偏高 | B.偏低 | C.无影响 | D.无法判断 |
您最近一年使用:0次



