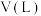名校
解题方法
1 . 25℃时,在等体积的①pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是___________ 。
您最近一年使用:0次
名校
解题方法
2 . “微生物法”处理含 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含 废水。
废水。
(1)硫酸盐还原菌能将水中的 转化为
转化为 ,
, 与
与 可反应生成
可反应生成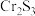 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在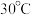 左右,温度过高,
左右,温度过高, 的去除率低的原因是
的去除率低的原因是___________ 。
(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为___________ 。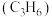 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。___________ ,乙为___________ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为___________ 。
 废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含
废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含 废水。
废水。(1)硫酸盐还原菌能将水中的
 转化为
转化为 ,
, 与
与 可反应生成
可反应生成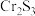 和
和 两种沉淀。写出
两种沉淀。写出 与
与 反应的离子方程式:
反应的离子方程式:(2)用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在
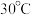 左右,温度过高,
左右,温度过高, 的去除率低的原因是
的去除率低的原因是(3)硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的
 会完全转化为
会完全转化为 ,则
,则 腐蚀后生成
腐蚀后生成 和
和 的物质的量之比为
的物质的量之比为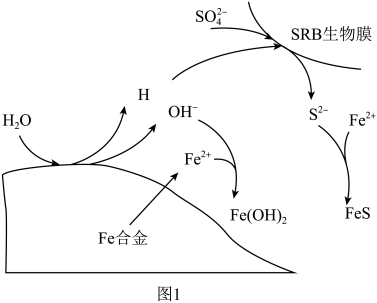
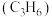 为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
为原料脱硝除去NO,将NO转化为对环境友好的物质。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。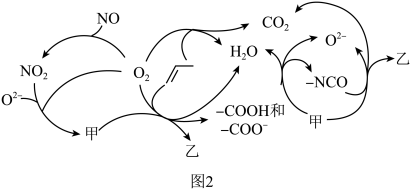
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次
名校
3 . 硝酸工业废气中含有 有害气体,需处理后才能排放.常用NaOH溶液吸收,其反应原理如下:
有害气体,需处理后才能排放.常用NaOH溶液吸收,其反应原理如下:
①
②
现有一定条件下0.5mol 和0.1molNO的混合气体恰好被300mLNaOH溶液完全吸收.则NaOH溶液的物质的量浓度为
和0.1molNO的混合气体恰好被300mLNaOH溶液完全吸收.则NaOH溶液的物质的量浓度为________  。(写出具体计算过程)
。(写出具体计算过程)
 有害气体,需处理后才能排放.常用NaOH溶液吸收,其反应原理如下:
有害气体,需处理后才能排放.常用NaOH溶液吸收,其反应原理如下:①

②

现有一定条件下0.5mol
 和0.1molNO的混合气体恰好被300mLNaOH溶液完全吸收.则NaOH溶液的物质的量浓度为
和0.1molNO的混合气体恰好被300mLNaOH溶液完全吸收.则NaOH溶液的物质的量浓度为 。(写出具体计算过程)
。(写出具体计算过程)
您最近一年使用:0次
4 . 某研究性学习小组,进行甲、乙、丙三组实验:各取 同浓度的盐酸,加入不同质量的同种铝合金颗粒,充分反应,产生气体。有关数据记录如下:
同浓度的盐酸,加入不同质量的同种铝合金颗粒,充分反应,产生气体。有关数据记录如下:
请回答以下问题:
(1)计算丙中产生气体的物质的量为___________ mol;
(2)实验中所用合金粉末中镁、铝的物质的量之比为___________ ;
(3)实验乙结束后的混合体系中加入一定量的NOH溶液,充分反应,得到固体M。如果固体M的质量不再减少,消耗NaOH的质量至少为___________ g。
 同浓度的盐酸,加入不同质量的同种铝合金颗粒,充分反应,产生气体。有关数据记录如下:
同浓度的盐酸,加入不同质量的同种铝合金颗粒,充分反应,产生气体。有关数据记录如下:| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(g) | 1.008 | 1.260 | 1.512 |
| 生成气体体积(mL)(标况) | 1075.2 | 1344 | 1344 |
(1)计算丙中产生气体的物质的量为
(2)实验中所用合金粉末中镁、铝的物质的量之比为
(3)实验乙结束后的混合体系中加入一定量的NOH溶液,充分反应,得到固体M。如果固体M的质量不再减少,消耗NaOH的质量至少为
您最近一年使用:0次
名校
解题方法
5 . 为确定某一铁铜样品中各成份的含量,某同学进行了如下实验:准确称取一份质量为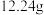 铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成
铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成 气体的体积为
气体的体积为 (已换成标准状况,假设生成的
(已换成标准状况,假设生成的 全部逸出),并测得剩余固体质量为
全部逸出),并测得剩余固体质量为 。各次实验的数据如下表:
。各次实验的数据如下表:
根据以上实验数据,请回答:
(1)上述实验当加入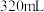 稀硝酸后,所发生反应的离子方程式为
稀硝酸后,所发生反应的离子方程式为______ 。
(2)稀硝酸的物质的量浓度为______  。
。
(3)样品中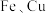 的物质的量之比为
的物质的量之比为______ 。
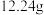 铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成
铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成 气体的体积为
气体的体积为 (已换成标准状况,假设生成的
(已换成标准状况,假设生成的 全部逸出),并测得剩余固体质量为
全部逸出),并测得剩余固体质量为 。各次实验的数据如下表:
。各次实验的数据如下表:稀硝酸体积 | 0 | 80 | 160 | 240 | 320 | 400 |
| 0 | 0.896 | 1.792 | 2.688 | 3.584 | 4.48 |
剩余固体质量 | 12.24 | 8.88 | 5.52 | 1.92 | 0 | 0 |
(1)上述实验当加入
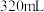 稀硝酸后,所发生反应的离子方程式为
稀硝酸后,所发生反应的离子方程式为(2)稀硝酸的物质的量浓度为
 。
。(3)样品中
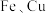 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
6 . 随着科学技术的进步,科学家研究出了种类繁多的合金来满足各行各业的需求。称取某镁铝合金 放入过量氢氧化钠溶液中,制得
放入过量氢氧化钠溶液中,制得 (标准状况下),试回答:
(标准状况下),试回答:
(1)目前用量最大的合金是__________ ;常见的一些合金硬度比其成分金属的__________ 。
(2)该合金中镁铝的物质的量之比是多少_______ (写出计算过程)。
 放入过量氢氧化钠溶液中,制得
放入过量氢氧化钠溶液中,制得 (标准状况下),试回答:
(标准状况下),试回答:(1)目前用量最大的合金是
(2)该合金中镁铝的物质的量之比是多少
您最近一年使用:0次
2024-01-24更新
|
46次组卷
|
2卷引用:山西省阳泉市2023-2024学年高一上学期期末教学质量监测化学试题
名校
解题方法
7 . 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
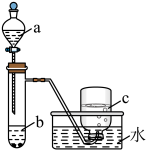
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。_______ 。硝酸所表现出的化学性质主要有_______
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是_______ g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且
的稀硝酸进行实验,若两种物质恰好反应都无剩余,且 只被还原成NO。则
只被还原成NO。则
①反应结束后的溶液中 、
、 的物质的量之比
的物质的量之比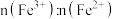 为
为_______ 。
②标准状况下,计算生成NO气体的体积_______ 。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有6.4g铜。
②待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用0.1mol Fe和含有0.3mol
 的稀硝酸进行实验,若两种物质恰好反应都无剩余,且
的稀硝酸进行实验,若两种物质恰好反应都无剩余,且 只被还原成NO。则
只被还原成NO。则①反应结束后的溶液中
 、
、 的物质的量之比
的物质的量之比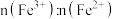 为
为②标准状况下,计算生成NO气体的体积
您最近一年使用:0次
2023-04-19更新
|
172次组卷
|
2卷引用:湖南省岳阳市岳汨联考2023-2024学年高二下学期5月月考化学试题
8 . 研究处理NOx、SO2对环境保护有着重要的意义。回答下列问题:
(1)二氧化硫在一定条件下可以发生如下反应:SO2(g)+NO2(g)⇌SO3(g)+NO(g)△H=-42kJ•mol-1。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如图所示:
进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如图所示: __ 。
②若A点对应实验中,SO2(g)的起始浓度为c0mol•L-1,经过tmin达到平衡状态,则该时段化学反应速率v(NO2)=__ mol•L-1•min-1。
③图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__ TD(填或“<”“=”或“<”)。
(2)2NO(g)+O2(g) 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应Ⅰ:2NO(g) N2O2(g)(快) △H1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2);
N2O2(g)(快) △H1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2);
反应Ⅱ:N2O2(g)+O2(g) 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2)。
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2)。
一定条件下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,平衡常数K=
2NO2(g)达到平衡状态,平衡常数K=___ (用含k1正、k1逆、k2正、k2逆的代数式表示)。反应Ⅰ的活化能EⅠ__ (填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数__ k2逆增大的倍数(填“>”“<”或“=”)。
(3)用测压法在刚性密闭容器中研究T℃时4NO(g) N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如表所示:
N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如表所示:
①20min时,NO的转化率α=__ 。
②T℃时,4NO(g) N2(g)+2NO2(g)反应的平衡常数Kp=
N2(g)+2NO2(g)反应的平衡常数Kp=__ (Kp为以分压表示的平衡常数)。
(1)二氧化硫在一定条件下可以发生如下反应:SO2(g)+NO2(g)⇌SO3(g)+NO(g)△H=-42kJ•mol-1。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
 进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如图所示:
进行多组实验(各组实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如图所示: 
②若A点对应实验中,SO2(g)的起始浓度为c0mol•L-1,经过tmin达到平衡状态,则该时段化学反应速率v(NO2)=
③图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC
(2)2NO(g)+O2(g)
 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:反应Ⅰ:2NO(g)
 N2O2(g)(快) △H1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2);
N2O2(g)(快) △H1<0 v1正=k1正c2(NO),v1逆=k1逆c(N2O2);反应Ⅱ:N2O2(g)+O2(g)
 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2)。
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2),v2逆=k2逆c2(NO2)。一定条件下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,平衡常数K=
2NO2(g)达到平衡状态,平衡常数K=②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数
(3)用测压法在刚性密闭容器中研究T℃时4NO(g)
 N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如表所示:
N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如表所示:| 反应时间/min | 0 | 10 | 20 | 30 | 40 |
| 压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
②T℃时,4NO(g)
 N2(g)+2NO2(g)反应的平衡常数Kp=
N2(g)+2NO2(g)反应的平衡常数Kp=
您最近一年使用:0次
2021-02-06更新
|
130次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高二下学期6月期末考试化学试题
2020高三·全国·专题练习
9 . 聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10−2 mol·L−1 K2Cr2O7溶液滴定至终点(滴定过程中Cr2O72-与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________ (填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____ 。
测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10−2 mol·L−1 K2Cr2O7溶液滴定至终点(滴定过程中Cr2O72-与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将
②计算该样品中铁的质量分数(写出计算过程)
您最近一年使用:0次
12-13高三上·上海虹口·阶段练习
10 . 钢铁工业是国家工业的基础。我国粗钢产量居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研。请对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62 g铁矿石样品投入足量的盐酸中充分反应,过滤,然后在滤液中加过量的NaOH溶液反应,过滤、洗涤、灼烧得4.80 g Fe2O3。则这种铁矿石样品含铁的量为________ 克。
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00 t生铁(含铁96%),至少需要这种铁矿石___________ 吨(保留两位小数)?
(3)取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
①则此钢样中铁和碳的物质的量之比________ 。
②再取三份不同质量的钢样粉末,分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
计算硫酸溶液的物质的量浓度_______ (要求计算过程)。
(3)若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少(用含m的代数式表示)_______ ?
(1)将6.62 g铁矿石样品投入足量的盐酸中充分反应,过滤,然后在滤液中加过量的NaOH溶液反应,过滤、洗涤、灼烧得4.80 g Fe2O3。则这种铁矿石样品含铁的量为
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00 t生铁(含铁96%),至少需要这种铁矿石
(3)取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
①则此钢样中铁和碳的物质的量之比
②再取三份不同质量的钢样粉末,分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | I | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
(3)若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少(用含m的代数式表示)
您最近一年使用:0次