名校
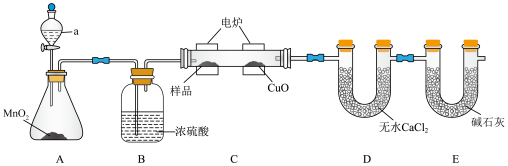
1 . 元素分析是研究有机化合物的表征手段之一、用燃烧法确定有机物化学式的装置如图(夹持装置已省略),电炉加热时利用纯氧氧化管内样品,根据产物的质量确定有机物的组成。回答下列问题:___________
(2)B装置中浓硫酸的作用是___________ ,C装置中CuO的作用是___________ 。
(3)D和E中的试剂不可调换,理由是___________ 。
(4)甲同学认为在E装置后加一个盛有碱石灰的U形管,可减少测定误差,乙同学认为这样做是合理的,理由是___________ 。
(5)完善装置后,若样品有机物M(可表示为CxHyOz)质量为2.22g,实验结束后(设生成物被完全吸收),D装置增重1.62g,E装置增重5.72g。M的质谱图如图所示。___________ 。
②写出分子式比M少2个H和1个O,且同时满足下列条件的结构简式:___________ 、___________ (任写两种)。
a.含有苯环,且苯环上只有一个取代基;
b.含碳碳双键和酯基,且含有三个甲基。
(2)B装置中浓硫酸的作用是
(3)D和E中的试剂不可调换,理由是
(4)甲同学认为在E装置后加一个盛有碱石灰的U形管,可减少测定误差,乙同学认为这样做是合理的,理由是
(5)完善装置后,若样品有机物M(可表示为CxHyOz)质量为2.22g,实验结束后(设生成物被完全吸收),D装置增重1.62g,E装置增重5.72g。M的质谱图如图所示。
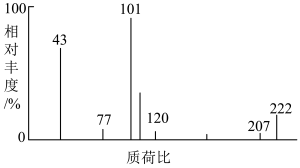
②写出分子式比M少2个H和1个O,且同时满足下列条件的结构简式:
a.含有苯环,且苯环上只有一个取代基;
b.含碳碳双键和酯基,且含有三个甲基。
您最近一年使用:0次
名校
解题方法
2 . 甲醇是重要的化工原料,利用合成气(CO、 、
、 )在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol
)在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol  和3.0 mol
和3.0 mol  ,在一定条件下发生反应:
,在一定条件下发生反应: ,测得
,测得 和
和 的物质的量随时间的变化如图所示。回答下列问题:
的物质的量随时间的变化如图所示。回答下列问题:___________ mol⋅L ⋅min
⋅min ,此时v(正)
,此时v(正)___________ v(逆)(填“>”“<”或“=”)。
②下列措施能增大反应速率的是___________ (填字母)。
A.升高温度 B.降低压强 C.减小 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂
(2)反应达到平衡时, 的转化率为
的转化率为___________ , 的体积分数为
的体积分数为___________ 。
(3)下列描述中能说明上述反应达到平衡状态的是___________(填字母)。
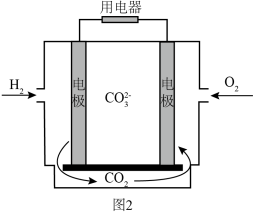
(4)化石燃料燃烧产生的 是主要的温室气体之一,使用电化学方法能够对
是主要的温室气体之一,使用电化学方法能够对 进行吸收。利用活泼金属与
进行吸收。利用活泼金属与 的反应,能够构建金属
的反应,能够构建金属 电池。其中一种
电池。其中一种 电池的模型如下图所示(图中
电池的模型如下图所示(图中 是固体):
是固体):___________ (填“正”或“负”)极,正极电极反应式为___________ 。
②该电池中每转移2 mol电子,能够吸收___________ mol  。
。
 、
、 )在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol
)在催化剂的作用下合成甲醇。在体积为1L的恒容密闭容器中,充入1.0 mol  和3.0 mol
和3.0 mol  ,在一定条件下发生反应:
,在一定条件下发生反应: ,测得
,测得 和
和 的物质的量随时间的变化如图所示。回答下列问题:
的物质的量随时间的变化如图所示。回答下列问题: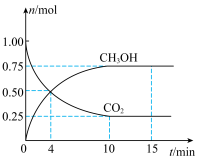
 ⋅min
⋅min ,此时v(正)
,此时v(正)②下列措施能增大反应速率的是
A.升高温度 B.降低压强 C.减小
 的浓度 D.加入合适的催化剂
的浓度 D.加入合适的催化剂(2)反应达到平衡时,
 的转化率为
的转化率为 的体积分数为
的体积分数为(3)下列描述中能说明上述反应达到平衡状态的是___________(填字母)。
A. 、 、 、 、 、 、 四种物质的浓度相等 四种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总压强不随时间的变化而变化 |
D.单位时间内消耗3 mol  的同时生成1 mol 的同时生成1 mol  |
(4)化石燃料燃烧产生的
 是主要的温室气体之一,使用电化学方法能够对
是主要的温室气体之一,使用电化学方法能够对 进行吸收。利用活泼金属与
进行吸收。利用活泼金属与 的反应,能够构建金属
的反应,能够构建金属 电池。其中一种
电池。其中一种 电池的模型如下图所示(图中
电池的模型如下图所示(图中 是固体):
是固体):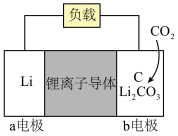
②该电池中每转移2 mol电子,能够吸收
 。
。
您最近一年使用:0次
今日更新
|
90次组卷
|
3卷引用:河南省名校联盟2023-2024学年高一下学期5月联考化学试题
名校
解题方法
3 . 硫的氧化物和氨的氧化物造成的环境问题日益受到关注。下列说法正确的是
A.硫在足量 中燃烧会生成 中燃烧会生成 |
B.在燃煤中加入 ,可以减少 ,可以减少 对环境的污染 对环境的污染 |
C. 能使酸性 能使酸性 溶液褪色,说明 溶液褪色,说明 具有漂白性 具有漂白性 |
D.汽车尾气中的主要大气污染物为 , , 和 和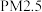 |
您最近一年使用:0次
名校
解题方法
4 . 乙炔是一种重要的化工原料,利用乙炔可以合成很多有机物,如下列转化关系: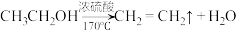
回答下面问题:
(1)写出实验室制备乙炔的化学方程式_______ ;制得的乙炔气体中含有H2S和PH3等气体而有难闻臭味,除去这些杂质气体,可将气体通过盛有_______ (填化学式)溶液的洗气瓶。
(2)有机物A中含有官能团的名称是_______ ,有机物D的结构简式为_______ 。
(3)反应③的反应类型是_______ ,有机物E的结构简式为_______ 。
(4)有机物F的名称为_______ ,其分子中位于同一平面的原子数是_______ 。
(5)写出反应②的化学方程式_______ 。
(6)写出反应⑦的化学方程式_______ 。

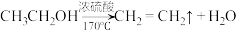
回答下面问题:
(1)写出实验室制备乙炔的化学方程式
(2)有机物A中含有官能团的名称是
(3)反应③的反应类型是
(4)有机物F的名称为
(5)写出反应②的化学方程式
(6)写出反应⑦的化学方程式
您最近一年使用:0次
真题
5 . 室温下, 水溶液中各含硫微粒物质的量分数
水溶液中各含硫微粒物质的量分数 随
随 变化关系如下图[例如
变化关系如下图[例如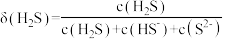 ]。已知:
]。已知: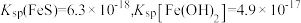 。
。
 水溶液中各含硫微粒物质的量分数
水溶液中各含硫微粒物质的量分数 随
随 变化关系如下图[例如
变化关系如下图[例如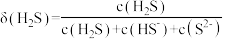 ]。已知:
]。已知: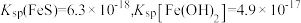 。
。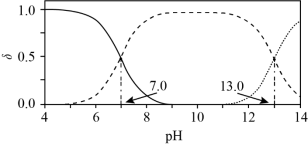
A.溶解度: 大于 大于 |
B.以酚酞为指示剂(变色的 范围8.2~10.0),用 范围8.2~10.0),用 标准溶液可滴定 标准溶液可滴定 水溶液的浓度 水溶液的浓度 |
C.忽略 的第二步水解, 的第二步水解, 的 的 溶液中 溶液中 水解率约为 水解率约为 |
D.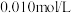 的 的 溶液中加入等体积 溶液中加入等体积 的 的 溶液,反应初始生成的沉淀是 溶液,反应初始生成的沉淀是 |
您最近一年使用:0次
名校
解题方法
6 . 某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体( ),并对其进行纯度测定和相关性质的实验。
),并对其进行纯度测定和相关性质的实验。
②NaNO2是白色固体,易被氧化。
(1)生产过程中,SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___________ 。
(2)写出“还原”步骤中生成NO反应的离子方程式___________ 。
(3)若使“吸收”步骤中NO、NO2完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___________ 。
(4)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取4.000g样品,将其配成500mL溶液。
b.先向锥形瓶内加入40.00ml 0.1000mol·L-1的H2SO4溶液,加热至40~50℃,冷却后再向其中加入12.00ml 0.1500mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与锥形瓶内溶液恰好完全反应,重复三次,平均每次消耗样品溶液40.00mL。求NaNO2晶体的纯度,请写出计算过程___________ 。(保留小数点后2位有效数字)已知: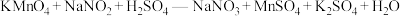 (未配平)。
(未配平)。
 ),并对其进行纯度测定和相关性质的实验。
),并对其进行纯度测定和相关性质的实验。
②NaNO2是白色固体,易被氧化。
(1)生产过程中,SO2从底部通入,硝酸从顶部以雾状喷下,其目的是
(2)写出“还原”步骤中生成NO反应的离子方程式
(3)若使“吸收”步骤中NO、NO2完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为
(4)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取4.000g样品,将其配成500mL溶液。
b.先向锥形瓶内加入40.00ml 0.1000mol·L-1的H2SO4溶液,加热至40~50℃,冷却后再向其中加入12.00ml 0.1500mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与锥形瓶内溶液恰好完全反应,重复三次,平均每次消耗样品溶液40.00mL。求NaNO2晶体的纯度,请写出计算过程
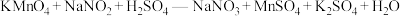 (未配平)。
(未配平)。
您最近一年使用:0次
真题
7 . 氢是清洁能源,硼氢化钠( )是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为
)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为 ,
, )
)

请回答:
(1)该反应能自发进行的条件是_______。
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
(3)为加速 水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比
水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比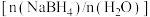 之间的关系,结果如图1所示。请解释ab段变化的原因
之间的关系,结果如图1所示。请解释ab段变化的原因_______ 。_______ 。该电池以 恒定电流工作14分钟,消耗
恒定电流工作14分钟,消耗 体积为
体积为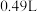 ,故可测得该电池将化学能转化为电能的转化率为
,故可测得该电池将化学能转化为电能的转化率为_______ 。[已知:该条件下 的摩尔体积为
的摩尔体积为 ;电荷量
;电荷量 电流
电流 时间
时间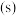 ;
;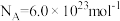 ;
;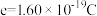 。]
。] )再生为
)再生为 。(已知:
。(已知: 是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比
是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比 计算方法;当
计算方法;当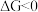 时,反应能自发进行。)
时,反应能自发进行。)
I.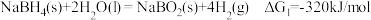
II.
III.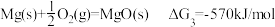
请书写一个方程式表示 再生为
再生为 的一种制备方法,并注明
的一种制备方法,并注明
_______ 。(要求:反应物不超过三种物质;氢原子利用率为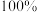 。)
。)
 )是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为
)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为 ,
, )
)
请回答:
(1)该反应能自发进行的条件是_______。
| A.高温 | B.低温 | C.任意温度 | D.无法判断 |
| A.升高溶液温度 | B.加入少量异丙胺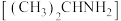 |
C.加入少量固体硼酸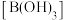 | D.增大体系压强 |
 水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比
水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比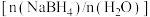 之间的关系,结果如图1所示。请解释ab段变化的原因
之间的关系,结果如图1所示。请解释ab段变化的原因
 恒定电流工作14分钟,消耗
恒定电流工作14分钟,消耗 体积为
体积为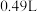 ,故可测得该电池将化学能转化为电能的转化率为
,故可测得该电池将化学能转化为电能的转化率为 的摩尔体积为
的摩尔体积为 ;电荷量
;电荷量 电流
电流 时间
时间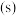 ;
;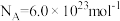 ;
;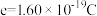 。]
。]
 )再生为
)再生为 。(已知:
。(已知: 是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比
是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比 计算方法;当
计算方法;当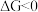 时,反应能自发进行。)
时,反应能自发进行。)I.
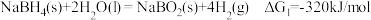
II.

III.
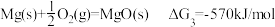
请书写一个方程式表示
 再生为
再生为 的一种制备方法,并注明
的一种制备方法,并注明
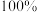 。)
。)
您最近一年使用:0次
名校
解题方法
8 . 自然界中,纯粹的典型晶体是不多的,大多数晶体是分子晶体、共价晶体、金属晶体和离子晶体之间的过渡晶体。以下列出了第三周期几种氧化物晶体中离子键的百分数。
提示:离子键的百分数是通过电负性的差值计算出来的,电负性的差值越大,离子键的百分数越大。
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:___________ 。
(2)硅元素位于元素周期表的___________ 区。基态硅原子的价层电子排布式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为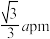 。
。
①该物质化学式为___________ ;
②距离每个B原子最近的Mg原子有___________ 个;
③该晶体密度为___________  。
。 含量。
含量。
(ⅰ)称取m克硅酸钠样品加热溶解后,配制为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色) (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为 ,体系中有沉淀。
,体系中有沉淀。
(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入 。
。
(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液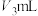 。
。
已知: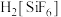 为强电解质,回答问题:
为强电解质,回答问题:
①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式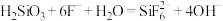 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为___________ 。
②样品中硅酸钠的纯度为___________ (用质量分数表示)。
| 氧化物 |  | MgO |  |  |
| 离子键百分数 | 62 | 50 | 41 | 33 |
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:
(2)硅元素位于元素周期表的
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为
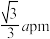 。
。①该物质化学式为
②距离每个B原子最近的Mg原子有
③该晶体密度为
 。
。
 含量。
含量。(ⅰ)称取m克硅酸钠样品加热溶解后,配制为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色)
 (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为 ,体系中有沉淀。
,体系中有沉淀。(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入
 。
。(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液
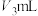 。
。已知:
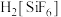 为强电解质,回答问题:
为强电解质,回答问题:①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式
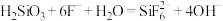 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为②样品中硅酸钠的纯度为
您最近一年使用:0次
名校
解题方法
9 . 工业上高炉炼铁产生的CO和CO2可以按如下流程脱除或利用。___________ 。
(2)煅烧产生的尾气可通过途径Ⅱ转化为CO2.。2分子氨和1分子CO2生产A,最终转化为尿素[CO(NH2)2];可通过途径Ⅲ转为b。
①下列说法正确的是___________ 。
A.黄铁(FeS2)可作为高炉炼铁的铁源
B.途径Ⅱ可实现反应转化MnO2+CO→CO2+Mn2O3
C.化合物A是一种盐
D.化合物B为CH3COONa
②尿素[CO(NH2)2]在较高温度下可以聚合成环状化合物三聚氰胺(C3H6N6),写出该反应的化学方程式___________ 。
(3)设计实验验证化合物A中含有N元素___________ ;写出实验过程中涉及的反应方程式___________ 。

已知: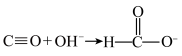 。请回答:
。请回答:
(2)煅烧产生的尾气可通过途径Ⅱ转化为CO2.。2分子氨和1分子CO2生产A,最终转化为尿素[CO(NH2)2];可通过途径Ⅲ转为b。
①下列说法正确的是
A.黄铁(FeS2)可作为高炉炼铁的铁源
B.途径Ⅱ可实现反应转化MnO2+CO→CO2+Mn2O3
C.化合物A是一种盐
D.化合物B为CH3COONa
②尿素[CO(NH2)2]在较高温度下可以聚合成环状化合物三聚氰胺(C3H6N6),写出该反应的化学方程式
(3)设计实验验证化合物A中含有N元素
您最近一年使用:0次
名校
解题方法
10 . 芳香族化合物 常用于药物及香料的合成,A有如图转化关系:
常用于药物及香料的合成,A有如图转化关系:
①A是芳香族化合物且苯环侧链上有两种处于不同环境下的氢原子;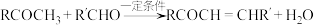 。
。
回答下列问题:
(1)B的分子式为_______ ,F具有的官能团名称是_______ 。
(2)由D生成E的反应类型为_______ ,由E生成F所需试剂及反应条件为_______ 。
(3)K分子中含有两个六元环,则K的结构简式为_______ 。
(4)由H生成I的化学方程式为_______ 。
(5)化合物F的同分异构体中能同时满足以下三个条件的有_______ 种(不考虑立体异构)。
①能与 溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。
溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。
其中核磁共振氢谱有6组峰,峰面积比为 的化合物的结构简式为
的化合物的结构简式为_______ 。
 常用于药物及香料的合成,A有如图转化关系:
常用于药物及香料的合成,A有如图转化关系:
①A是芳香族化合物且苯环侧链上有两种处于不同环境下的氢原子;
②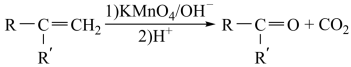 ;
;
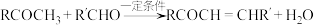 。
。回答下列问题:
(1)B的分子式为
(2)由D生成E的反应类型为
(3)K分子中含有两个六元环,则K的结构简式为
(4)由H生成I的化学方程式为
(5)化合物F的同分异构体中能同时满足以下三个条件的有
①能与
 溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。
溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。其中核磁共振氢谱有6组峰,峰面积比为
 的化合物的结构简式为
的化合物的结构简式为
您最近一年使用:0次



