名校
1 . 关于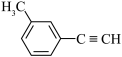 的说法正确的是
的说法正确的是
| A.分子中有6个原子共线 | B.分子中共平面的原子数目最多为14 |
| C.分子中的苯环由单双键交替组成 | D.该有机物的一氯代物有两种 |
您最近一年使用:0次
名校
2 . 环境科学研究发现, 也是一种温室效应气体,与
也是一种温室效应气体,与 相比,虽然
相比,虽然 在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。
在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。 的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为
的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为__________ ;在相同温度和压强下,1mol  和1mol CO经过相同反应时间测得如下实验数据:
和1mol CO经过相同反应时间测得如下实验数据:
试分析在相同温度时,催化剂2催化下 的转化率更高的原因是
的转化率更高的原因是___________ 。
(2)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1mol 、0.4mol CO和相同催化剂。实验测得A、B容器中
、0.4mol CO和相同催化剂。实验测得A、B容器中 的转化率随时间的变化关系如图所示:
的转化率随时间的变化关系如图所示: 的转化率随时间的变化关系是图中的
的转化率随时间的变化关系是图中的___________ 曲线(填“a”或“b”)。
②要缩短b曲线对应容器达到平衡的时间,但不改变 的平衡转化率,在催化剂一定的情况下可采取的措施是
的平衡转化率,在催化剂一定的情况下可采取的措施是___________ (答出一条即可)。
③500℃该反应的化学平衡常数K=___________ (用最简分数表示)。
④实验测定该反应的反应速率 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度,计算M处的
分别是正、逆反应速率常数,c为物质的量浓度,计算M处的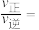
___________ (保留两位小数)。
 也是一种温室效应气体,与
也是一种温室效应气体,与 相比,虽然
相比,虽然 在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。
在大气中的含量很低,增温潜势却是二氧化碳的298倍,对全球气候的增温效应在未来将越来越显著,已引起科学家的极大关注。
 的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为
的能量变化如上图所示,则无催化剂条件下该反应的逆反应的活化能为 和1mol CO经过相同反应时间测得如下实验数据:
和1mol CO经过相同反应时间测得如下实验数据:| 实验 | 温度/℃ | 催化剂 |  的转化率/% 的转化率/% |
| 实验1 | 400 | 催化剂1 | 9.5 |
| 400 | 催化剂2 | 10.6 | |
| 实验2 | 500 | 催化剂1 | 12.3 |
| 500 | 催化剂2 | 13.5 |
 的转化率更高的原因是
的转化率更高的原因是(2)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1mol
 、0.4mol CO和相同催化剂。实验测得A、B容器中
、0.4mol CO和相同催化剂。实验测得A、B容器中 的转化率随时间的变化关系如图所示:
的转化率随时间的变化关系如图所示:
 的转化率随时间的变化关系是图中的
的转化率随时间的变化关系是图中的②要缩短b曲线对应容器达到平衡的时间,但不改变
 的平衡转化率,在催化剂一定的情况下可采取的措施是
的平衡转化率,在催化剂一定的情况下可采取的措施是③500℃该反应的化学平衡常数K=
④实验测定该反应的反应速率
 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度,计算M处的
分别是正、逆反应速率常数,c为物质的量浓度,计算M处的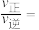
您最近一年使用:0次
名校
3 . 已知反应: 。在一定压强下,按
。在一定压强下,按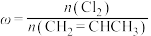 向密闭容器中充入氯气与丙烯。图甲表示平衡时丙烯的体积分数(
向密闭容器中充入氯气与丙烯。图甲表示平衡时丙烯的体积分数( )与温度(T)、
)与温度(T)、 的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的
的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的
 。在一定压强下,按
。在一定压强下,按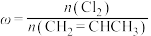 向密闭容器中充入氯气与丙烯。图甲表示平衡时丙烯的体积分数(
向密闭容器中充入氯气与丙烯。图甲表示平衡时丙烯的体积分数( )与温度(T)、
)与温度(T)、 的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的
的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的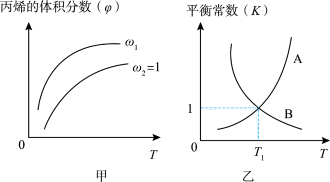
A.图甲中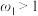 |
| B.图乙中,线A表示正反应的平衡常数 |
| C.若在恒容绝热装置中开始上述反应,达到平衡时装置内的气体压强始终不变 |
D.温度 、 、 , , 的转化率约为33.3% 的转化率约为33.3% |
您最近一年使用:0次
名校
解题方法
4 . 在恒温恒压下,向密闭容器中充入4mol  和2mol
和2mol  ,发生如下反应:
,发生如下反应: △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是
 和2mol
和2mol  ,发生如下反应:
,发生如下反应: △H<0,2min后,反应达到平衡,生成
△H<0,2min后,反应达到平衡,生成 为1.4mol,同时放出热量Q kJ。则下列分析正确的是
为1.4mol,同时放出热量Q kJ。则下列分析正确的是A.若反应开始时容器体积为2L,则 |
B.若把条件“恒温恒压”改为“恒压恒容”,则平衡后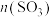 大于1.4mol 大于1.4mol |
C.2min后,向容器中再通入一定量的 气体,重新达到平衡时 气体,重新达到平衡时 的含量变小 的含量变小 |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于Q kJ |
您最近一年使用:0次
名校
5 . 直接排放含 的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关
的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关 性质的探究活动。
性质的探究活动。
(1)写出证明 弱氧化性的化学方程式
弱氧化性的化学方程式________ 。
(2)写出下图装置A中滴加盐酸仪器的名称:________ 。
①甲同学认为按照A→C→F顺序连接装置可以比较亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是________ 。
②丙同学设计的合理实验方案为A→________ →尾气处理(填字母)。其中装置C的作用是________ 。证明亚硫酸酸性强于次氯酸的实验现象是________ 。
(4)利用下图的装置可测定装置A残液中 的含量。量取1.00mL残液于烧瓶中,加适量蒸馏水稀释,加热使
的含量。量取1.00mL残液于烧瓶中,加适量蒸馏水稀释,加热使 全部逸出并与锥形瓶中的
全部逸出并与锥形瓶中的 溶液恰好完全反应,然后用浓度为
溶液恰好完全反应,然后用浓度为 溶液测定锥形瓶中生成的酸的含量,消耗NaOH溶液的体积为20.00mL。
溶液测定锥形瓶中生成的酸的含量,消耗NaOH溶液的体积为20.00mL。
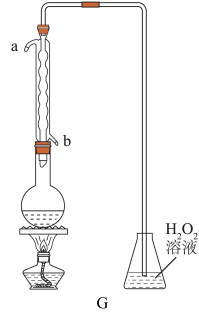
残液中 的含量为
的含量为________  。
。
 的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关
的烟气会形成酸雨,危害环境。某化学实验小组进行如下有关 性质的探究活动。
性质的探究活动。(1)写出证明
 弱氧化性的化学方程式
弱氧化性的化学方程式(2)写出下图装置A中滴加盐酸仪器的名称:
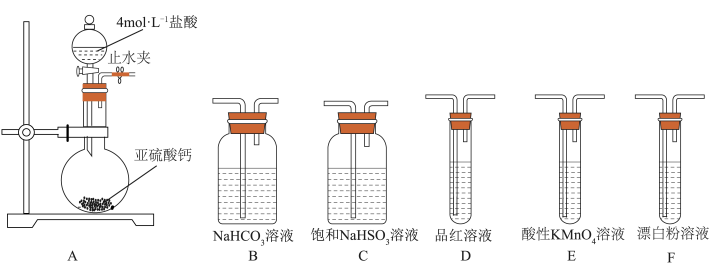
①甲同学认为按照A→C→F顺序连接装置可以比较亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是
②丙同学设计的合理实验方案为A→
(4)利用下图的装置可测定装置A残液中
 的含量。量取1.00mL残液于烧瓶中,加适量蒸馏水稀释,加热使
的含量。量取1.00mL残液于烧瓶中,加适量蒸馏水稀释,加热使 全部逸出并与锥形瓶中的
全部逸出并与锥形瓶中的 溶液恰好完全反应,然后用浓度为
溶液恰好完全反应,然后用浓度为 溶液测定锥形瓶中生成的酸的含量,消耗NaOH溶液的体积为20.00mL。
溶液测定锥形瓶中生成的酸的含量,消耗NaOH溶液的体积为20.00mL。
残液中
 的含量为
的含量为 。
。
您最近一年使用:0次
2024-03-14更新
|
233次组卷
|
2卷引用:广东省深圳市高级中学2021-2022学年高一下学期期中考试化学试卷
解题方法
6 . 铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有 、
、 、FeO、
、FeO、 等)来制备绿矾(
等)来制备绿矾( )和氧化铝,其工艺流程如图:
)和氧化铝,其工艺流程如图:
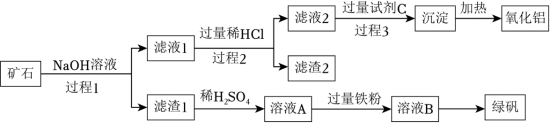
回答下列问题:
(1)过程1中能加快矿石与NaOH溶液反应速率的措施是___________ 。(答一条)
(2)滤渣1的主要成分是___________ ,举例说明滤渣2的用途___________ 。
(3)向溶液A中加入过量铁粉发生反应的离子方程式为:___________ 。
(4)写出由滤液1生成滤液2的离子方程式___________ 。
(5)用来配制试剂C的物质的电子式为:___________ 。
(6)绿矾晶体易被空气中的氧气氧化变质,宜密封保存放置。为探究制备的绿矾样品是否变质,具体的实验操作为___________ 。
 、
、 、FeO、
、FeO、 等)来制备绿矾(
等)来制备绿矾( )和氧化铝,其工艺流程如图:
)和氧化铝,其工艺流程如图:
回答下列问题:
(1)过程1中能加快矿石与NaOH溶液反应速率的措施是
(2)滤渣1的主要成分是
(3)向溶液A中加入过量铁粉发生反应的离子方程式为:
(4)写出由滤液1生成滤液2的离子方程式
(5)用来配制试剂C的物质的电子式为:
(6)绿矾晶体易被空气中的氧气氧化变质,宜密封保存放置。为探究制备的绿矾样品是否变质,具体的实验操作为
您最近一年使用:0次
7 . 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(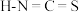 ),其原因是
),其原因是___________ 。
(2) 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为___________ ; 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为___________ 。
(3)卤素互化物如 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为___________ 。
(4)请推测① 、②
、②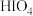 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为___________ (填序号)。
(5) 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为___________ 个;若该晶胞的边长为 ,则该晶体的密度为
,则该晶体的密度为___________  (写出表达式)。
(写出表达式)。

(1)拟卤素
 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(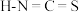 ),其原因是
),其原因是(2)
 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为(3)卤素互化物如
 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为(4)请推测①
 、②
、②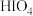 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为(5)
 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为 ,则该晶体的密度为
,则该晶体的密度为 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
21-22高一·全国·课后作业
名校
8 . 如图为实验室某浓盐酸试剂瓶标签上的部分数据,试根据标签.上的相关数据回答下列问题:.
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:______ ;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:______ 。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取______ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是______ 。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:  HCl的质量分数:36.5% |
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
2024-02-22更新
|
74次组卷
|
6卷引用:河北省隆化存瑞中学2022-2023学年高一上学期第一次月考化学试题
河北省隆化存瑞中学2022-2023学年高一上学期第一次月考化学试题河南省濮阳市第一高级中学2022-2023学年高一上学期期中质量检测化学试题黑龙江省齐齐哈尔市普高联谊校2022-2023学年高三上学期期中考试化学试题(已下线)第一章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)山东省威海市文登新一中2021-2022学年高一上学期12月月考化学试题河南省周口市鹿邑县2023-2024学年高一上学期1月期末化学试题
9 . 锰和硫能形成多种重要的化合物,在工业生产中有广泛应用。回答下列问题:
(1)烟气中的SO2可与CO进行综合处理。
已知:Ⅰ.S(g)+O2(g)=SO2(g) ΔH=-297.3kJ·mol-1
Ⅱ.CO的燃烧热283kJ·mol-1
Ⅲ.相关化学键的键能数据如表所示:
①表中x=___________ 。
②写出CO的燃烧热的热化学方程式:___________ 。
③以物质的量之比为1﹕2的SO2和CO充入密闭容器中发生反应SO2(g)+2CO(g) S(g)+2CO2(g) ΔH,SO2(g)和S(g)平衡时的体积分数(φ)与温度(T)的关系如图所示,图中表示SO2(g)平衡时的体积分数与温度关系的曲线为
S(g)+2CO2(g) ΔH,SO2(g)和S(g)平衡时的体积分数(φ)与温度(T)的关系如图所示,图中表示SO2(g)平衡时的体积分数与温度关系的曲线为___________ (填“L1”或“L2”),T0℃时该反应的平衡常数K=___________ 。

(2)Na2S2O8具有强氧化性,其中的S元素为+6价,Na2S2O8用于检验水相中的Mn2+时,生成SO 且溶液变为紫红色,1molNa2S2O8中过氧键的数目为
且溶液变为紫红色,1molNa2S2O8中过氧键的数目为___________ ;检验Mn2+的反应中氧化剂和还原剂的物质的量之比为___________ 。
(3)MnO2可用如图装置电解方法制备,电解池中间是质子交换膜,分隔开的两室溶液分别为足量的硫酸钠溶液和足量的硫酸锰溶液,则阴极室中的溶液为___________ ;电解产生的MnO2沉积在电极上,若一段时间后该电极所在的溶液质量减轻了4.45g,则电路中转移电子的物质的量为___________ mol。

(1)烟气中的SO2可与CO进行综合处理。
已知:Ⅰ.S(g)+O2(g)=SO2(g) ΔH=-297.3kJ·mol-1
Ⅱ.CO的燃烧热283kJ·mol-1
Ⅲ.相关化学键的键能数据如表所示:
| 化学键 | C O O | C=O | O=O |
| 键能(E)/kJ·mol-1 | 1076 | x | 498 |
②写出CO的燃烧热的热化学方程式:
③以物质的量之比为1﹕2的SO2和CO充入密闭容器中发生反应SO2(g)+2CO(g)
 S(g)+2CO2(g) ΔH,SO2(g)和S(g)平衡时的体积分数(φ)与温度(T)的关系如图所示,图中表示SO2(g)平衡时的体积分数与温度关系的曲线为
S(g)+2CO2(g) ΔH,SO2(g)和S(g)平衡时的体积分数(φ)与温度(T)的关系如图所示,图中表示SO2(g)平衡时的体积分数与温度关系的曲线为
(2)Na2S2O8具有强氧化性,其中的S元素为+6价,Na2S2O8用于检验水相中的Mn2+时,生成SO
 且溶液变为紫红色,1molNa2S2O8中过氧键的数目为
且溶液变为紫红色,1molNa2S2O8中过氧键的数目为(3)MnO2可用如图装置电解方法制备,电解池中间是质子交换膜,分隔开的两室溶液分别为足量的硫酸钠溶液和足量的硫酸锰溶液,则阴极室中的溶液为

您最近一年使用:0次
名校
解题方法
10 . 如图是元素周期表的一部分:
(1)写出①的元素符号___________ ,与①同周期的主族元素中,第一电离能比①大的有___________ 种。
(2)基态锑(Sb)原子的价电子排布式为___________ ;[H2F]+[SbF6]-(氟酸锑)是一种超强酸,[H2F]+离子的空间构型为___________ 。
(3)下列说法正确的是___________
a.元素Sb位于p区
b.基态P原子中,电子占据的最高能级符号为M
c.乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺低
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如表所示,解释GaN、GaP熔点变化原因___________ 。
(5)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是___________ 。
(6)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如下图所示,已知该晶体密度为ρg•cm-3,NA是阿伏加德罗常数的值,BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________ pm(列式即可)。

| N | |||
| P | |||
| ① | |||
| Sb |
(2)基态锑(Sb)原子的价电子排布式为
(3)下列说法正确的是
a.元素Sb位于p区
b.基态P原子中,电子占据的最高能级符号为M
c.乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺低
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如表所示,解释GaN、GaP熔点变化原因
| 物质 | GaN | GaP |
| 熔点/℃ | 1700 | 1480 |
(6)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如下图所示,已知该晶体密度为ρg•cm-3,NA是阿伏加德罗常数的值,BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为

您最近一年使用:0次



