名校
解题方法
1 . 特定条件下制备的石墨烯具有常温超导的性质,这一发现将导致很多领域发生颠覆性的革命。镓(Ga)、硒(Se)的单质及某些化合物如砷化镓等都是常用的半导体材料,超导材料和半导体材料都广泛应用于航空航天测控、光纤通信等领域。请回答下列问题:
(1)基态硒原子的核外价电子排布式为_____ ,与硒同周期的p区元素中第一电离能大于硒的元素有_____ 种,SeO3的空间构型是_____ 。
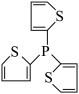
(2)一种膦配体M在有机合成中具有较高的应用价值,M的结构简式如图所示:_____ 。
②M中磷原子的杂化轨道类型为_____ 。
③膦配体M是_____ (填“极性”或“非极性”)分子。
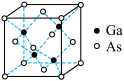
(3)CaAs为原子晶体,密度为ρg .cm-3,其晶胞结构如图所示,则As原子的配位数为_____ ,若Ga和As的原子半径分别为apm和bpm,CaAs晶胞中原子的体积占晶胞体积的百分率为A,则阿伏加德罗常数的值NA=_____ (用字母表示)。
(1)基态硒原子的核外价电子排布式为
(2)一种膦配体M在有机合成中具有较高的应用价值,M的结构简式如图所示:
②M中磷原子的杂化轨道类型为
③膦配体M是
(3)CaAs为原子晶体,密度为ρg .cm-3,其晶胞结构如图所示,则As原子的配位数为
您最近一年使用:0次
名校
解题方法
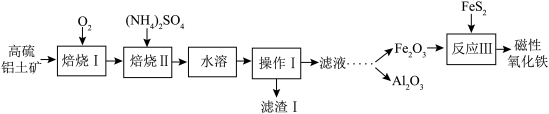
2 . 某地以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)为原料提取氧化铝和磁性氧化铁,用直接碱溶法往往会因形成铝硅酸钠沉淀[NamAlmSinO16(OH)5]而造成铝损失。一种改进后的流程如下:_____ ;NamAlmSinO16(OH)5中的m和n之间的关系式为_____ ;
(2)写出滤渣I主要成分的一种用途:_____ ;
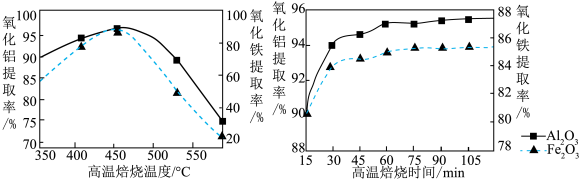
(3)“焙烧Ⅱ”的过程是由氧化铝、氧化铁制得可溶性的NH4Al(SO4) 2、NH4Fe(SO4)2.提取率随温度、时间的变化曲线如图所示,最佳的焙烧时间与温度是_____ 。若用NH4R(SO4) 2表示NH4Al(SO4) 2、NH4Fe(SO4) 2,则相关反应的化学方程式为_____ 。
(5)为了测定Wg高硫铝土矿中铝元素的含量,将流程中制取的Al2O3溶解于足量稀硫酸中,配制成250mL溶液,取出25mL,加入amLcmol·L-1EDTA标准溶液,调节溶液pH约为4.2,煮沸,冷却后用bmol·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液VmL(已知Al3+、Cu2+与EDTA反应的化学计量数之比均为1:1)。则Wg高硫铝土矿中铝元素的质量分数为_____ (用含V、a、b、c的代数式表示)
(2)写出滤渣I主要成分的一种用途:
(3)“焙烧Ⅱ”的过程是由氧化铝、氧化铁制得可溶性的NH4Al(SO4) 2、NH4Fe(SO4)2.提取率随温度、时间的变化曲线如图所示,最佳的焙烧时间与温度是
| A.因为原子半径:Na>S,所以离子半径:Na+>S2- |
| B.因为非金属性:S>Si,所以气态氢化物的稳定性:SiH4<H2S |
| C.因为非金属性:O>S,所以沸点:H2S>H2O |
| D.因为金属性:Na>Al,所以碱性:NaOH>Al(OH)3 |
(5)为了测定Wg高硫铝土矿中铝元素的含量,将流程中制取的Al2O3溶解于足量稀硫酸中,配制成250mL溶液,取出25mL,加入amLcmol·L-1EDTA标准溶液,调节溶液pH约为4.2,煮沸,冷却后用bmol·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液VmL(已知Al3+、Cu2+与EDTA反应的化学计量数之比均为1:1)。则Wg高硫铝土矿中铝元素的质量分数为
您最近一年使用:0次
3 . 下列各组物质中,不能满足有图所示关系的一组是(每个箭头表示一步转化)
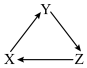
| 选项 | X | Y | Z |
| A | Si | SiO2 | Na2SiO3 |
| B | FeCl2 | Fe | FeCl3 |
| C | Al2O3 | AlCl3 | Al(OH)3 |
| D | SO2 | SO3 | H2SO4 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
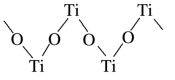
4 . 钛(22Ti)和钛的合金大量用于航空工业,有“空间金属”之称,制备钛的一种流程如下。___________ ,有___________ 个未成对电子。
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。___________ 。
②化合物乙中采取sp3杂化原子的第一电离能由大到小的顺序为___________ 。
(3)硫酸氧钛晶体中,阳离子为链状聚合形式的离子,结构如图所示。___________ ,此阳离子化学式为___________ 。
(4)钙钛矿晶体的结构与晶胞如下图。___________ 个氧离子包围成配位八面体,钙离子位于立方晶胞的体心,被___________ 个氧离子包围。
②钙钛矿晶体的化学式为___________ 。

(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。

②化合物乙中采取sp3杂化原子的第一电离能由大到小的顺序为
(3)硫酸氧钛晶体中,阳离子为链状聚合形式的离子,结构如图所示。
(4)钙钛矿晶体的结构与晶胞如下图。
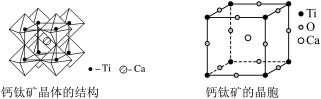
②钙钛矿晶体的化学式为
您最近一年使用:0次
5 . 化学学习小组研究有机化合物的结构和性质,进行如下实验。
 .利用燃烧法确定有机化合物的组成。
.利用燃烧法确定有机化合物的组成。
已知:某有机化合物由C、H、O三种元素组成。取7.4 g样品在电炉中加热使其充分燃烧,实验装置如下。___________ →F(填字母顺序,装置不可重复使用)。
(2)如果C装置中没有CuO,则A装置中碱石灰的增重可能会___________ (填“增大”或“减小”)。
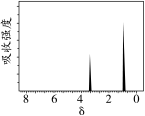
(3)实验测得A装置增重17.6g、B装置增重9.0g。质谱图显示,该有机化合物的相对分子质量为74,写出该有机化合物的分子式___________ 。
(4)核磁共振氢谱(如图所示)显示,该有机化合物两组峰的面积比为2:3,推测该有机化合物的结构简式为___________ 。 .卤代烃消去反应的探究。
.卤代烃消去反应的探究。
向圆底烧瓶中加入2.0g NaOH和15mL无水乙醇,搅拌。再加入5mL 1-溴丁烷和几片碎瓷片,微热。产生的气体依次通过试管A、B后,试管B溶液紫红色逐渐褪去。___________ 。试管A中盛放的试剂是___________ 。
(6)已知:溴乙烷的沸点:38.4℃;1-溴丁烷的沸点:101.6℃。
①从微粒间作用角度分析、解释溴乙烷的沸点低于1-溴丁烷的原因___________ 。
②有同学用溴乙烷代替1-溴丁烷进行实验,发现试管B中酸性KMnO4溶液不褪色。试分析实验失败的可能原因___________ 。
 .利用燃烧法确定有机化合物的组成。
.利用燃烧法确定有机化合物的组成。已知:某有机化合物由C、H、O三种元素组成。取7.4 g样品在电炉中加热使其充分燃烧,实验装置如下。

(2)如果C装置中没有CuO,则A装置中碱石灰的增重可能会
(3)实验测得A装置增重17.6g、B装置增重9.0g。质谱图显示,该有机化合物的相对分子质量为74,写出该有机化合物的分子式
(4)核磁共振氢谱(如图所示)显示,该有机化合物两组峰的面积比为2:3,推测该有机化合物的结构简式为
 .卤代烃消去反应的探究。
.卤代烃消去反应的探究。向圆底烧瓶中加入2.0g NaOH和15mL无水乙醇,搅拌。再加入5mL 1-溴丁烷和几片碎瓷片,微热。产生的气体依次通过试管A、B后,试管B溶液紫红色逐渐褪去。

(6)已知:溴乙烷的沸点:38.4℃;1-溴丁烷的沸点:101.6℃。
①从微粒间作用角度分析、解释溴乙烷的沸点低于1-溴丁烷的原因
②有同学用溴乙烷代替1-溴丁烷进行实验,发现试管B中酸性KMnO4溶液不褪色。试分析实验失败的可能原因
您最近一年使用:0次
解题方法
6 . 回答下列问题。
Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) 2H2(g)
2H2(g) 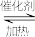 CH3OH(g) △H=Q
CH3OH(g) △H=Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
(1)判断反应达到平衡状态的依据是_______。
(2)由表中数据判断Q_______ 0 (填“>”、“ ”或“<”);
”或“<”);
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10 min后,达到平衡时测得c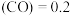 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v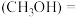
_______ mol /(L·min),CO的转化率为_______ 。
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s) CO2(g)
CO2(g) 2CO(g) 平衡常数K1
2CO(g) 平衡常数K1
C(s) H2O(g)
H2O(g) CO(g)
CO(g) H2(g) 平衡常数K2
H2(g) 平衡常数K2
CO(g) H2O(g)
H2O(g) H2(g)
H2(g) CO2(g) 平衡常数K3
CO2(g) 平衡常数K3
则K1、K2 、K3之间的关系是:_______ 。
Ⅱ.一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g) Y(s)+2Z(g)△H>0测得反应的逆反应速率随时间变化的关系如图,
Y(s)+2Z(g)△H>0测得反应的逆反应速率随时间变化的关系如图,_______ 、_______ (填写两项)。
Ⅰ.甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)
 2H2(g)
2H2(g) 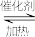 CH3OH(g) △H=Q
CH3OH(g) △H=Q下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(1)判断反应达到平衡状态的依据是_______。
| A.混合气体的密度不变 |
| B.混合气体的平均相对分子质量不变 |
| C.生成CH3OH的速率与消耗CO的速率相等 |
| D.CH3OH、CO、H2的浓度都不再发生变化 |
(2)由表中数据判断Q
 ”或“<”);
”或“<”);(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10 min后,达到平衡时测得c
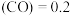 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v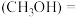
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)
 CO2(g)
CO2(g) 2CO(g) 平衡常数K1
2CO(g) 平衡常数K1C(s)
 H2O(g)
H2O(g) CO(g)
CO(g) H2(g) 平衡常数K2
H2(g) 平衡常数K2CO(g)
 H2O(g)
H2O(g) H2(g)
H2(g) CO2(g) 平衡常数K3
CO2(g) 平衡常数K3则K1、K2 、K3之间的关系是:
Ⅱ.一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)
 Y(s)+2Z(g)△H>0测得反应的逆反应速率随时间变化的关系如图,
Y(s)+2Z(g)△H>0测得反应的逆反应速率随时间变化的关系如图,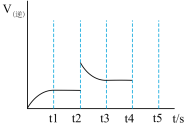
您最近一年使用:0次
解题方法
7 . Lyocell纤维是一种使用NMMO的水溶液加工纤维素所得的产品。Lyocell纤维的纺织品具有良好的吸湿透气性。NMMO是一种无毒的有机化合物。纤维素加工的工艺流程如下图所示:___________ 。
(2)Lyocell纤维被称为“绿色纤维”,从工艺流程来看,原因是___________ 。
(3)NMMO的合成路线如下(各步合成条件省略):
①化合物丙所含的官能团名称是___________ 和___________ 。
②加热加压条件下,环氧乙烷合成丙的反应式是___________ 。
③化合物丁属于脂环化合物,其结构简式是___________ 。
④化合物戊的一种同分异构体无支链,且与氢氧化钠水溶液共热时生成一种无机气体,该气体能使湿润的石蕊试纸变蓝。则该同分异构体的结构简式是___________ 。
(4)Lyocell纤维制成的面料容易勾丝,不耐暴晒。而腈纶弹性优异,耐光性好。因此,将两种纤维混纺,可以实现性能互补。请写出以(3)中化合物甲为原料合成腈纶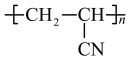 的各步反应式:
的各步反应式:___________ 。
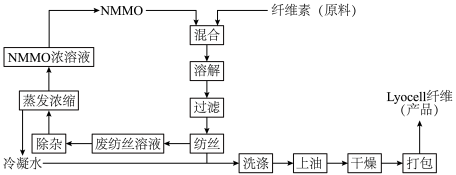
(2)Lyocell纤维被称为“绿色纤维”,从工艺流程来看,原因是
(3)NMMO的合成路线如下(各步合成条件省略):
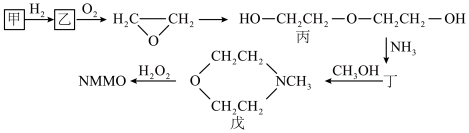
①化合物丙所含的官能团名称是
②加热加压条件下,环氧乙烷合成丙的反应式是
③化合物丁属于脂环化合物,其结构简式是
④化合物戊的一种同分异构体无支链,且与氢氧化钠水溶液共热时生成一种无机气体,该气体能使湿润的石蕊试纸变蓝。则该同分异构体的结构简式是
(4)Lyocell纤维制成的面料容易勾丝,不耐暴晒。而腈纶弹性优异,耐光性好。因此,将两种纤维混纺,可以实现性能互补。请写出以(3)中化合物甲为原料合成腈纶
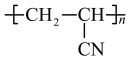 的各步反应式:
的各步反应式:
您最近一年使用:0次
名校
8 . 苯甲酸的熔点为122.13℃,微溶于水,易溶于酒精,实验室制备少量苯甲酸的流程如图:

| A.“操作1”过程中玻璃棒的作用为搅拌 | B.“操作2”为酸化过程,可使用稀硫酸 |
| C.“冷凝回流”过程中一定需要直形蒸馏管 | D.为提高苯甲酸固体的纯度,可用热水洗涤晶体 |
您最近一年使用:0次
2024-07-12更新
|
57次组卷
|
2卷引用:广西壮族自治区柳州高级中学2022-2023学年高三上学期1月考试理科综合试题-高中化学
名校
9 . 环戊二烯可以和烯基硼烷反应生成5-降冰片烯-2-醇(方程式如图所示,M表示甲基),下列说法正确的是
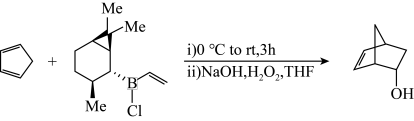
| A.环戊二烯与溴化氢发生加成反应的产物(只考虑位置异构)理论上最多有3种 |
| B.5-降冰片烯-2-醇可发生加聚反应、取代反应、还原反应和消去反应 |
| C.环戊二烯和1,3-丁二烯互为同系物 |
| D.5-降冰片烯-2-醇分子中含有两个手性碳原子 |
您最近一年使用:0次
名校
解题方法
10 . 在有机合成中,常需将官能团消除或增加,下列合成路线不简洁的是
A.乙烯→乙二醇: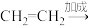 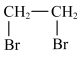  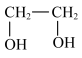 |
B.溴乙烷→乙醇: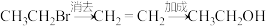 |
C.1-溴丁烷→1-丁炔: 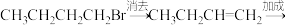 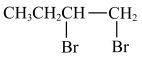  |
D.乙烯→乙炔: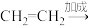 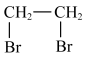  |
您最近一年使用:0次
2024-06-15更新
|
84次组卷
|
17卷引用:课后-3.5.1 有机合成的主要任务-人教版2019选择性必修3
课后-3.5.1 有机合成的主要任务-人教版2019选择性必修3(已下线)第20讲 有机合成的主要任务(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)黑龙江省七台河市勃利县高级中学2021-2022学年高二下学期期中考试化学试题(已下线)考点44 有机综合推断-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第55练 有机合成-2023年高考化学一轮复习小题多维练(全国通用)第五节 有机合成陕西省延安市第一中学2021-2022学年高二下学期期中考试化学试题重庆市凤鸣山中学2020-2021学年高二下学期期中考试化学试题(人教2019)选择性必修3第三章 第五节 有机合成江苏省盐城市东台创新高级中学2020-2021学年高二3月份月检测化学试题宁夏吴忠市青铜峡市高级中学2020-2021学年高二下学期期末考试化学试题(已下线)烃的衍生物——课时7有机合成河北省唐山市乐亭第一中学2022-2023学年高二下学期6月月考化学试题广东省汕头市金禧中学2023-024学年高三上学期第一次阶段考试化学试题3.5有机合成 随堂练习(已下线)专题05 有机反应类型与有机合成 -备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)浙江省新力量联盟2023-2024学年高二下学期4月期中考试化学试题



