名校
解题方法
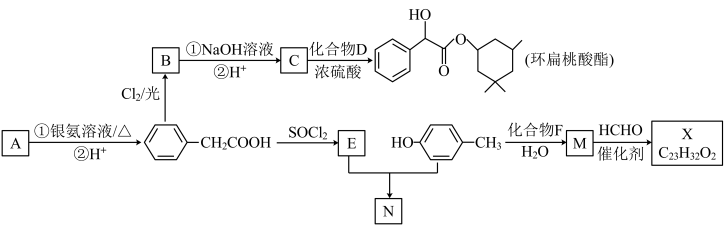
1 . 用于治疗脑动脉硬化的环扁桃酸酯、防老剂X及化合物N的合成线路如下:
已知:RCOOH RCOCl
RCOCl RCOOR'(R、R'代表烃基)
RCOOR'(R、R'代表烃基)
(1)A含有的官能团是___________ 。
(2)B的结构简式是___________ 。
(3)合成环扁桃酸酯,在B中引入氯原子的目的是___________ 。
(4)生成环扁桃酸酯的化学方程式是___________ 。
(5)N的结构简式是___________ 。
(6)化合物F(C4H9OH)除羟基外,只含一种化学环境的氢原子。下列说法正确的是___________ 。
a.F能发生酯化反应
b.F不能发生消去反应
c.与F含有相同官能团的同分异构体还有3种
(7)有机物M、X均能与NaOH反应,溴水与有机物X混合无明显现象。
①M的结构简式是___________ 。
②“M→X”,HCHO与M发生___________ 反应,然后经脱水缩合生成X。
③X的结构简式是___________ 。

已知:RCOOH
 RCOCl
RCOCl RCOOR'(R、R'代表烃基)
RCOOR'(R、R'代表烃基)(1)A含有的官能团是
(2)B的结构简式是
(3)合成环扁桃酸酯,在B中引入氯原子的目的是
(4)生成环扁桃酸酯的化学方程式是
(5)N的结构简式是
(6)化合物F(C4H9OH)除羟基外,只含一种化学环境的氢原子。下列说法正确的是
a.F能发生酯化反应
b.F不能发生消去反应
c.与F含有相同官能团的同分异构体还有3种
(7)有机物M、X均能与NaOH反应,溴水与有机物X混合无明显现象。
①M的结构简式是
②“M→X”,HCHO与M发生
③X的结构简式是
您最近一年使用:0次
名校
解题方法
2 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。
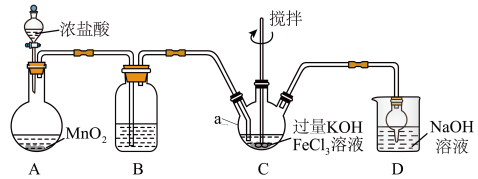
(1)仪器a的名称是______ ,装置B中除杂质所用试剂是______ ,装置D的作用是_____ 。
(2)A中发生反应的化学方程式为______ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是______ 。
(4)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和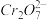 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的化学方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)写出C中总反应的离子方程式:
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和
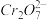 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
710次组卷
|
8卷引用:2019年四川省绵阳市高三第二次诊断性考试理综化学试题
2019年四川省绵阳市高三第二次诊断性考试理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题辽宁省实验中学、东北育才学校、鞍山一中、大连八中、大连二十四中五校联考2021-2022学年高三上学期期末联考化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题十八化学实验综合题解题策略(已下线)实验综合题
3 . 三种气体 X、Y、Z 的相对分子质量关系为 Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
| A.原子数相等的三种气体,质量最大是 Z |
| B.若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1 mol |
| C.同温同压下,同质量的三种气体,气体密度最小的是X |
| D.同温下,体积相同的两容器分别充agY气体和2agZ气体,则压强之比为1:2 |
您最近一年使用:0次
2022-12-25更新
|
1623次组卷
|
52卷引用:2016届湖北省武汉市高三下学期2月调研理综化学试卷
2016届湖北省武汉市高三下学期2月调研理综化学试卷2016-2017学年江西省南昌二中高一上月考一化学试卷2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷2016届辽宁省葫芦岛市第一高级中学高三上学期第二次周考理综化学试卷河北省“名校联盟”(五校联考)2018届高三上学期教学质量监测(一)化学试题湖北省武汉市部分重点中学2017-2018学年高一上学期期中考试化学试题山东省沂水县第一中学2018届高三下学期第2次模拟化学试题【全国百强校】河北省邢台市第一中学2017-2018学年高二下学期第三次月考化学试题(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量【市级联考】山东省泰安市2019届高三上学期期中考试化学试题【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题云南省新平县一中2018-2019学年高一上学期12月月考化学试题云南省元江县一中2018-2019学年高一下学期2月份考试化学试题(已下线)2019年7月2日 《每日一题》2020年高考一轮复习-阿伏加德罗定律及其推论的应用河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题四川省广安市邻水县邻水实验学校2019-2020学年高一上学期第一次月考化学试题河北省邯郸市2019-2020学年高一上学期期中考试化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高一10月月考化学试题广西南宁市第三中学2019-2020学年高一上学期期中考试化学试题安徽省合肥十中2019-2020学年高一上学期期中考试化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题1内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题广东省江门市第一中学2019-2020学年高一上学期10月月考化学试题山西省忻州市第一中学2019-2020学年高一上学期第二次月考化学试题内蒙古呼和浩特市第十六中学2020-2021学年高一上学期第一次质量检测化学试题福建省厦门一中2019-2020学年高一上学期第一次月考(10月)化学试题安徽省合肥市肥东县第二中学2020-2021学年高一上学期期末考试化学试题专题1 第2课时气体摩尔体积-高中化学苏教2019版必修第一册(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时11 物质的量、气体摩尔体积-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)提升卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)化学-2022年高考押题预测卷02(山东卷)(已下线)必刷卷04-2022年高考化学考前信息必刷卷(山东专用)(已下线)考点02 物质的量 气体摩尔体积-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第04讲 物质的量 气体摩尔体积 (练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省龙西北八校联合体2022-2023学年高三上学期开学考试化学试题河南省南阳市第一中学校2023届高三上学期第二次阶段考试化学试题重庆市万州纯阳中学2022-2023学年高三上学期8月月考化学试题(已下线)专题五 化学常用计量与化学计算-实战高考·二轮复习核心突破山东莒县第一中学2022-2023学年高一上学期12月月考化学试题山东省烟台第一中学2022-2023学年高一上学期月考化学试题山东省烟台第一中学2022-2023学年高一上学期期末调研化学试题安徽省安庆市桐城中学2022-2023学年高一上学期第二次教学质量检测化学试题第二章 物质的量化学实验基本技能 第6讲 物质的量山东省枣庄市第八中学南校2022-2023学年高一1月线上测试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题广西浦北中学2023-2024学年高一上学期10月月考化学试题福建省泉州市安溪一中、养正中学、惠安一中、实验中学2023-2024学年高一上学期期中考化学试题
12-13高二上·四川遂宁·期中
名校
解题方法
4 . 下列说法错误的是
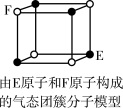
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
252次组卷
|
8卷引用:2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷
名校
解题方法
5 . 现有NaHCO3和Na2CO3的混合物,为了测定二者的质量,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量 )。
已知:CaCl2是一种优良的吸水剂,不与CO2反应;碱石灰是NaOH固体和CaO固体的混合物,碱石灰既可以吸水又可以与CO2反应。
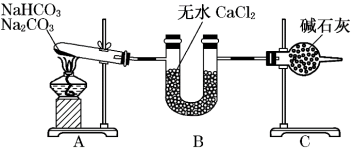
(1)B装置的作用是____ 。
(2)C装置的作用是____ 。
(3)若在装置A的试管中装入NaHCO3和Na2CO3的混合物3.80g,用酒精灯加热到反应完全,此时U型管B增重0.18g,干燥管C增重mg,则原固体混合物中Na2CO3的质量为____ g。
(4)A装置中发生反应的化学方程式为:____ 。
(5)请通过计算,判断m的取值范围____ 。
已知:CaCl2是一种优良的吸水剂,不与CO2反应;碱石灰是NaOH固体和CaO固体的混合物,碱石灰既可以吸水又可以与CO2反应。

(1)B装置的作用是
(2)C装置的作用是
(3)若在装置A的试管中装入NaHCO3和Na2CO3的混合物3.80g,用酒精灯加热到反应完全,此时U型管B增重0.18g,干燥管C增重mg,则原固体混合物中Na2CO3的质量为
(4)A装置中发生反应的化学方程式为:
(5)请通过计算,判断m的取值范围
您最近一年使用:0次
12-13高一上·黑龙江大庆·期末
名校
解题方法
6 . 将2molNaHCO3和一定量(不为0)的Na2O2固体混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,则反应后固体的物质的量n(mol)的取值范围是
| A.n=1 | B.1<n<2 | C.2≤n<4 | D.n≥4 |
您最近一年使用:0次
2022-09-22更新
|
1089次组卷
|
6卷引用:2011—2012学年度黑龙江大庆实验中学高一上学期期末考试化学试卷
名校
7 . 2020年2月19日下午,国家卫生健康委办公厅、国家中医药管理局办公室联合发出《关于印发新型冠状病毒肺炎诊疗方案(试行第六版)的通知》。此次诊疗方案抗病毒治疗中增加了磷酸氯喹和盐酸阿比多尔两种药物,盐酸阿比朵尔( )其中一条合成路线如下:
)其中一条合成路线如下:
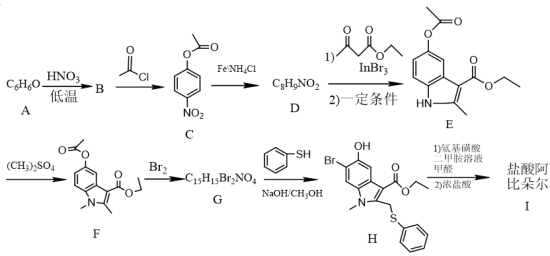
回答下列问题:
(1)H的含氧官能团名称为_______ ,B的名称_______ 。
(2)C→D、E→F的反应类型分别是_______ 、_______ 。
(3)写出F→G的化学方程式为_______ 。
(4)芳香化合物M是D的同分异构体,满足下列条件的M有_______ 种,
①含有氨基(—NH2) ②既能水解,又能发生银镜反应
写出其中一种有五种不同化学环境的氢,个数比为2:2:2:2:1的结构简式_______ 。
(5)参照上述合成路线,写出以硝基苯和乙酰乙酸乙酯(CH3COCH2COOCH2CH3或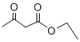 )为原料合成
)为原料合成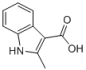 (无机试剂任选)。
(无机试剂任选)。_________
 )其中一条合成路线如下:
)其中一条合成路线如下:
回答下列问题:
(1)H的含氧官能团名称为
(2)C→D、E→F的反应类型分别是
(3)写出F→G的化学方程式为
(4)芳香化合物M是D的同分异构体,满足下列条件的M有
①含有氨基(—NH2) ②既能水解,又能发生银镜反应
写出其中一种有五种不同化学环境的氢,个数比为2:2:2:2:1的结构简式
(5)参照上述合成路线,写出以硝基苯和乙酰乙酸乙酯(CH3COCH2COOCH2CH3或
 )为原料合成
)为原料合成 (无机试剂任选)。
(无机试剂任选)。
您最近一年使用:0次
2022-09-14更新
|
137次组卷
|
2卷引用:湖南省岳阳市2020届高三教学质量监测(二)理综化学试题
解题方法
8 . 研究NO2、NO、N2O、CO等大气污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2(g)+CO(g) CO2(g)+NO(g) ∆H=—234kJ/mol
CO2(g)+NO(g) ∆H=—234kJ/mol
②N2(g)+O2(g) 2NO(g) ∆H= +179.5kJ/mol
2NO(g) ∆H= +179.5kJ/mol
③2NO (g)+O2(g) 2NO2(g) ∆H=—112.3kJ/mol
2NO2(g) ∆H=—112.3kJ/mol
试写出NO与CO反应生成无污染物气体的热化学方程式:_______ 。
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO 4CO2+N2,某温度下,在2L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个标准大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在2L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个标准大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时N2的化学反应速率ν(N2)=
,则反应开始到平衡时N2的化学反应速率ν(N2)=_______ 。若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为0.04mol/L、0.06mol/L、0.04 mol/L、0.01 mol/L,则化学反应朝_______ 方向进行。(填“正反应,逆反应,平衡状态”)
(3)一氧化二氮可发生2N2O(g) 2N2(g)+O2(g)。不同温度(T),N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半所需的相应时间),则T1
2N2(g)+O2(g)。不同温度(T),N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半所需的相应时间),则T1_______ T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=_______ (用P0表示)。

(4)某研究小组探究催化剂对CO、NO转化的影响。将CO和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:

①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为_______ 。
②若低于200℃,图中曲线I脱氮率随温度升高变化不大的主要原因 为_______ 。
(5)工业上消除氮氧化物的常用方法是SCR(选择性催化还原)脱硝法,反应原理为4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH<0,某科研小组通过系列实验,分析得出脱硝率与氨氮比(
4N2(g)+6H2O(g) ΔH<0,某科研小组通过系列实验,分析得出脱硝率与氨氮比( 表示氨氮比)关系如图,从图看出最佳氨氮比为2.2,理由是
表示氨氮比)关系如图,从图看出最佳氨氮比为2.2,理由是_______ 。

(1)已知:①NO2(g)+CO(g)
 CO2(g)+NO(g) ∆H=—234kJ/mol
CO2(g)+NO(g) ∆H=—234kJ/mol②N2(g)+O2(g)
 2NO(g) ∆H= +179.5kJ/mol
2NO(g) ∆H= +179.5kJ/mol③2NO (g)+O2(g)
 2NO2(g) ∆H=—112.3kJ/mol
2NO2(g) ∆H=—112.3kJ/mol试写出NO与CO反应生成无污染物气体的热化学方程式:
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO
 4CO2+N2,某温度下,在2L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个标准大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在2L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个标准大气压,5秒时反应达到平衡时,容器的压强变为原来的 ,则反应开始到平衡时N2的化学反应速率ν(N2)=
,则反应开始到平衡时N2的化学反应速率ν(N2)=(3)一氧化二氮可发生2N2O(g)
 2N2(g)+O2(g)。不同温度(T),N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半所需的相应时间),则T1
2N2(g)+O2(g)。不同温度(T),N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半所需的相应时间),则T1
(4)某研究小组探究催化剂对CO、NO转化的影响。将CO和NO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率),结果如图所示:

①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为
②若低于200℃,图中曲线I脱氮率随温度升高变化不大的
(5)工业上消除氮氧化物的常用方法是SCR(选择性催化还原)脱硝法,反应原理为4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) ΔH<0,某科研小组通过系列实验,分析得出脱硝率与氨氮比(
4N2(g)+6H2O(g) ΔH<0,某科研小组通过系列实验,分析得出脱硝率与氨氮比( 表示氨氮比)关系如图,从图看出最佳氨氮比为2.2,理由是
表示氨氮比)关系如图,从图看出最佳氨氮比为2.2,理由是
您最近一年使用:0次
14-15高二上·辽宁沈阳·期中
名校
解题方法
9 . 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应: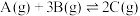
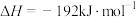 。向M、N中,分别通入x
。向M、N中,分别通入x A和y
A和y B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
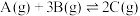
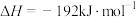 。向M、N中,分别通入x
。向M、N中,分别通入x A和y
A和y B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是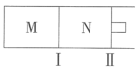
| A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
B.若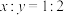 ,则平衡时M中的转化率: ,则平衡时M中的转化率: |
C.若 ,当M中放出热量172.8 ,当M中放出热量172.8 时,A的转化率为90% 时,A的转化率为90% |
D.若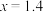 , , ,N中达到平衡时容积为2L,C为0.4 ,N中达到平衡时容积为2L,C为0.4 ,则反应起始时N的容积为2.6L ,则反应起始时N的容积为2.6L |
您最近一年使用:0次
2022-09-04更新
|
762次组卷
|
6卷引用:2014-2015学年辽宁省沈阳二中高二上学期期中化学试卷
(已下线)2014-2015学年辽宁省沈阳二中高二上学期期中化学试卷夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 转化率与产率的相关计算(提升练)辽宁省大连市第一中学2021-2022学年高二上学期阶段性学情反馈(二)化学试题第二章 本章复习提升3吉林省长春市十一高中2022-2023学年高二上学期第一学程考试化学试题(已下线)化学反应速率与化学平衡——进阶学习
9-10高二下·北京·期末
名校
10 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是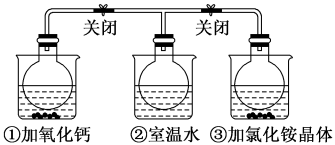
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1138次组卷
|
23卷引用:2010年北京市八一中学高二第二学期期末考试化学试卷
(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)选择题11-15



