名校
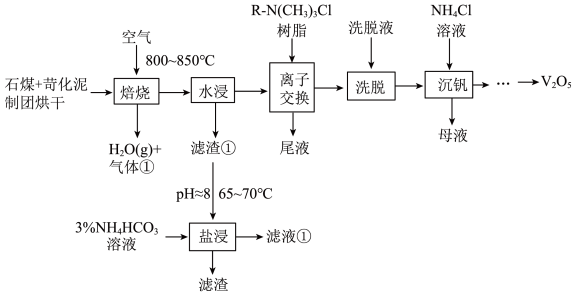
1 . V2O5是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取V2O5的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
Ⅱ.室温下,偏钒酸钙[Ca(VO3)2]和偏铝酸钙均难溶于水。
回答下列问题:
(1)钒原子的价层电子排布式为__________ ;焙烧生成的偏钒酸盐中钒的化合价为_________ ,产生的气体①为_________ (填化学式)。
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为__________ (填化学式)。
(3)碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为_________ ;CO2加压导入盐浸工序可提高浸出率的原因为___________ ;浸取后低浓度的滤液①进入__________ (填工序名称),可实现钒元素的充分利用。
(4)洗脱工序中洗脱液的主要成分为_________ (填化学式)。
Ⅱ.室温下,偏钒酸钙[Ca(VO3)2]和偏铝酸钙均难溶于水。
回答下列问题:
(1)钒原子的价层电子排布式为
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为
(3)碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为
(4)洗脱工序中洗脱液的主要成分为
您最近一年使用:0次
真题
2 . 一定条件下,存在 缺陷位的LiH晶体能吸附
缺陷位的LiH晶体能吸附 使其分解为N,随后N占据缺陷位(如图)。下列说法错误的是
使其分解为N,随后N占据缺陷位(如图)。下列说法错误的是
 缺陷位的LiH晶体能吸附
缺陷位的LiH晶体能吸附 使其分解为N,随后N占据缺陷位(如图)。下列说法错误的是
使其分解为N,随后N占据缺陷位(如图)。下列说法错误的是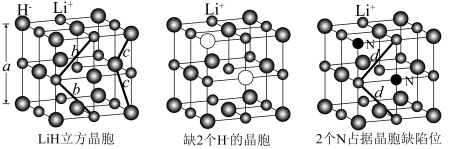
A. | B.半径: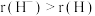 |
C. | D.LiH晶体为离子晶体 |
您最近一年使用:0次
3 .  金首饰是由金和其他合金材料(主要为银、铜和镍)所制造而成的首饰。现使用硫酸亚铁铵还原-重铬酸钾返滴定的方法检测
金首饰是由金和其他合金材料(主要为银、铜和镍)所制造而成的首饰。现使用硫酸亚铁铵还原-重铬酸钾返滴定的方法检测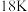 金首饰中金含量。
金首饰中金含量。
步骤一:配制 重铬酸钾
重铬酸钾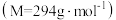 标准溶液
标准溶液
称取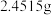 基准重铬酸钾试剂于烧杯中,加蒸馏水溶解后,将溶液和洗涤液全部转移至容量瓶中,摇匀,加水定容。
基准重铬酸钾试剂于烧杯中,加蒸馏水溶解后,将溶液和洗涤液全部转移至容量瓶中,摇匀,加水定容。
步骤二:标定硫酸亚铁铵溶液的浓度
取 硫酸亚铁铵溶液,置于
硫酸亚铁铵溶液,置于 锥形瓶中,加入
锥形瓶中,加入 硫磷混酸、
硫磷混酸、 水、3滴二苯胺磺酸钠,用重铬酸钾标准溶液滴定至溶液从绿色转变为紫红色为终点。平行标定3次,消耗重铬酸钾标准溶液的平均体积为
水、3滴二苯胺磺酸钠,用重铬酸钾标准溶液滴定至溶液从绿色转变为紫红色为终点。平行标定3次,消耗重铬酸钾标准溶液的平均体积为 。
。
步骤三:溶解试样
称取约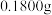 试样,加入浓盐酸和
试样,加入浓盐酸和 质量分数为
质量分数为 的硝酸,在水浴上加热溶解,并蒸发至湿盐状。取下冷却,用
的硝酸,在水浴上加热溶解,并蒸发至湿盐状。取下冷却,用 浓盐酸洗涤杯壁,蒸发至湿盐状,取下冷却,再用浓盐酸重复操作两次,驱尽硝酸根。
浓盐酸洗涤杯壁,蒸发至湿盐状,取下冷却,再用浓盐酸重复操作两次,驱尽硝酸根。
步骤四:滴定试样
冷却后加入 水,摇匀,边搅动边加入
水,摇匀,边搅动边加入 硫酸亚铁氨标准溶液,继续搅动约
硫酸亚铁氨标准溶液,继续搅动约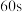 ,加入
,加入 硫酸磷酸混合酸、
硫酸磷酸混合酸、 水、3滴二苯胺磺酸钠指示剂溶液,以重铬酸钾标准溶液滴定至溶液从绿色转变为紫红色即为终点。消耗重铬酸钾标准溶液的平均体积为
水、3滴二苯胺磺酸钠指示剂溶液,以重铬酸钾标准溶液滴定至溶液从绿色转变为紫红色即为终点。消耗重铬酸钾标准溶液的平均体积为 。
。
回答下列问题:
(1)步骤一中容量瓶的规格为___________ ,重铬酸钾标准溶液的浓度为___________ (保留两位有效数字);步骤一中错误的实验操作为___________ 。
(2)步骤二实验过程需用到的实验仪器有___________ (填字母)。___________ (用离子方程式回答)。
(4)步骤三中驱尽硝酸根的目的是___________ 。
(5)步骤四“滴定试样”中发生反应 ;
;___________ (写出离子方程式)。该试样中 的含量为
的含量为___________ (列出算式即可)。
(6)查阅相关资料得知白色 金中的
金中的 在酸性体系中与重铬酸钾溶液发生反应,导致测定结果
在酸性体系中与重铬酸钾溶液发生反应,导致测定结果___________ (填“偏高”或者“偏低”)。
 金首饰是由金和其他合金材料(主要为银、铜和镍)所制造而成的首饰。现使用硫酸亚铁铵还原-重铬酸钾返滴定的方法检测
金首饰是由金和其他合金材料(主要为银、铜和镍)所制造而成的首饰。现使用硫酸亚铁铵还原-重铬酸钾返滴定的方法检测 金首饰中金含量。
金首饰中金含量。步骤一:配制
 重铬酸钾
重铬酸钾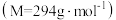 标准溶液
标准溶液称取
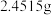 基准重铬酸钾试剂于烧杯中,加蒸馏水溶解后,将溶液和洗涤液全部转移至容量瓶中,摇匀,加水定容。
基准重铬酸钾试剂于烧杯中,加蒸馏水溶解后,将溶液和洗涤液全部转移至容量瓶中,摇匀,加水定容。步骤二:标定硫酸亚铁铵溶液的浓度
取
 硫酸亚铁铵溶液,置于
硫酸亚铁铵溶液,置于 锥形瓶中,加入
锥形瓶中,加入 硫磷混酸、
硫磷混酸、 水、3滴二苯胺磺酸钠,用重铬酸钾标准溶液滴定至溶液从绿色转变为紫红色为终点。平行标定3次,消耗重铬酸钾标准溶液的平均体积为
水、3滴二苯胺磺酸钠,用重铬酸钾标准溶液滴定至溶液从绿色转变为紫红色为终点。平行标定3次,消耗重铬酸钾标准溶液的平均体积为 。
。步骤三:溶解试样
称取约
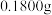 试样,加入浓盐酸和
试样,加入浓盐酸和 质量分数为
质量分数为 的硝酸,在水浴上加热溶解,并蒸发至湿盐状。取下冷却,用
的硝酸,在水浴上加热溶解,并蒸发至湿盐状。取下冷却,用 浓盐酸洗涤杯壁,蒸发至湿盐状,取下冷却,再用浓盐酸重复操作两次,驱尽硝酸根。
浓盐酸洗涤杯壁,蒸发至湿盐状,取下冷却,再用浓盐酸重复操作两次,驱尽硝酸根。步骤四:滴定试样
冷却后加入
 水,摇匀,边搅动边加入
水,摇匀,边搅动边加入 硫酸亚铁氨标准溶液,继续搅动约
硫酸亚铁氨标准溶液,继续搅动约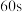 ,加入
,加入 硫酸磷酸混合酸、
硫酸磷酸混合酸、 水、3滴二苯胺磺酸钠指示剂溶液,以重铬酸钾标准溶液滴定至溶液从绿色转变为紫红色即为终点。消耗重铬酸钾标准溶液的平均体积为
水、3滴二苯胺磺酸钠指示剂溶液,以重铬酸钾标准溶液滴定至溶液从绿色转变为紫红色即为终点。消耗重铬酸钾标准溶液的平均体积为 。
。回答下列问题:
(1)步骤一中容量瓶的规格为
(2)步骤二实验过程需用到的实验仪器有
(4)步骤三中驱尽硝酸根的目的是
(5)步骤四“滴定试样”中发生反应
 ;
; 的含量为
的含量为(6)查阅相关资料得知白色
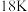 金中的
金中的 在酸性体系中与重铬酸钾溶液发生反应,导致测定结果
在酸性体系中与重铬酸钾溶液发生反应,导致测定结果
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.下表是几种弱酸常温下的电离常数。
(1)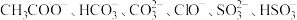 结合H+的能力由强到弱的顺序:
结合H+的能力由强到弱的顺序:____ 。
(2)下列离子方程式书写错误的是_______ 。
a.少量CO2通入NaClO溶液中:
b.少量SO2通入次氯酸钙溶液中: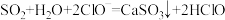
c.过量CO2通入澄清石灰石中:
(3)在反应 达到平衡后,要使HClO的浓度增大可加入_______。
达到平衡后,要使HClO的浓度增大可加入_______。
Ⅱ.已知:25℃时,电离平衡常数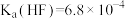 ,
,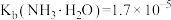 。25℃时,浓度均为
。25℃时,浓度均为 4种溶液:①盐酸;②HF溶液;③NaOH溶液;④氨水溶液。
4种溶液:①盐酸;②HF溶液;③NaOH溶液;④氨水溶液。
(4)由水电离出的c(H+)由大到小的是_______ (填序号)。
Ⅲ.水的电离平衡曲线如图所示。_______ 。
(6)在水中加少量酸,可实现A点向_______ 点移动。
(7)若在B点温度下,某溶液的pH=7,则该溶液_______ (填字母)。
a.呈中性 b.呈碱性 c.呈酸性 d.c(OH-)=100c(H+)
(8)常温下,pH=12的NaOH溶液与pH=1的HCl溶液按一定比例混合,所得溶液pH=2,则NaOH溶液与HCl溶液的体积比为_______ 。
| CH3COOH | H2CO3 | HClO | H2SO3 |
| Ka=1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=4.0×10-8 | Ka1=1.4×10-2 Ka2=6.0×10-8 |
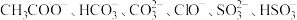 结合H+的能力由强到弱的顺序:
结合H+的能力由强到弱的顺序:(2)下列离子方程式书写错误的是
a.少量CO2通入NaClO溶液中:

b.少量SO2通入次氯酸钙溶液中:
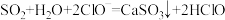
c.过量CO2通入澄清石灰石中:

(3)在反应
 达到平衡后,要使HClO的浓度增大可加入_______。
达到平衡后,要使HClO的浓度增大可加入_______。| A.NaOH | B.HCl | C.NaHCO3 | D.H2O |
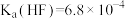 ,
,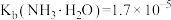 。25℃时,浓度均为
。25℃时,浓度均为 4种溶液:①盐酸;②HF溶液;③NaOH溶液;④氨水溶液。
4种溶液:①盐酸;②HF溶液;③NaOH溶液;④氨水溶液。(4)由水电离出的c(H+)由大到小的是
Ⅲ.水的电离平衡曲线如图所示。

(6)在水中加少量酸,可实现A点向
(7)若在B点温度下,某溶液的pH=7,则该溶液
a.呈中性 b.呈碱性 c.呈酸性 d.c(OH-)=100c(H+)
(8)常温下,pH=12的NaOH溶液与pH=1的HCl溶液按一定比例混合,所得溶液pH=2,则NaOH溶液与HCl溶液的体积比为
您最近一年使用:0次
名校
解题方法
5 . I.下表是该小组研究影响过氧化氢 分解速率的因素时采集的一组数据:用
分解速率的因素时采集的一组数据:用
 制取
制取 所需的时间(秒)
所需的时间(秒)
(1)该研究小组在设计方案时,考虑了浓度、_______ 、_______ 等因素对过氧化氢分解速率的影响。
II.分析 的催化分解原理
的催化分解原理
催化 分解的原理分为两步,总反应可表示为:
分解的原理分为两步,总反应可表示为: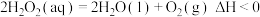 。若第一步反应为
。若第一步反应为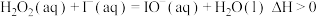 慢反应
慢反应
(2)则第二步反应为_______  快反应
快反应
III.高温条件下二氧化碳可以氢化制备乙烯。
(3)已知下列反应的热化学方程式:
i.
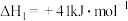 ;
;
ii.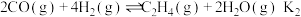
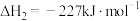 ;
;
反应iii: 的
的
_______  ,平衡常数
,平衡常数
_______ (用 、
、 表示)。
表示)。
(4)研究表明,合成气体在 、起始
、起始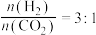 时,
时, 平衡转化率随温度的变化如图1所示,乙烯选择性随温度的变化如图2所示[乙烯选择性
平衡转化率随温度的变化如图1所示,乙烯选择性随温度的变化如图2所示[乙烯选择性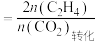 ]:
]: 平衡转化率随温度升高出现先下降后升高可能的原因是
平衡转化率随温度升高出现先下降后升高可能的原因是_______ 。
②700K时,反应i的
_______ (列出计算式即可)。
(5)关于上述反应,下列说法正确的是_______(填选项字母)。
 分解速率的因素时采集的一组数据:用
分解速率的因素时采集的一组数据:用
 制取
制取 所需的时间(秒)
所需的时间(秒)30% | 15% | 10% | 5% | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360s | 480s | 540s | 720s |
 催化剂、加热 催化剂、加热 | 10s | 25s | 60s | 120s |
II.分析
 的催化分解原理
的催化分解原理催化
 分解的原理分为两步,总反应可表示为:
分解的原理分为两步,总反应可表示为: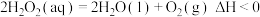 。若第一步反应为
。若第一步反应为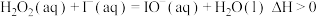 慢反应
慢反应(2)则第二步反应为
 快反应
快反应III.高温条件下二氧化碳可以氢化制备乙烯。
(3)已知下列反应的热化学方程式:
i.

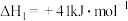 ;
;ii.
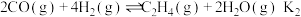
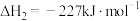 ;
;反应iii:
 的
的
 ,平衡常数
,平衡常数
 、
、 表示)。
表示)。(4)研究表明,合成气体在
 、起始
、起始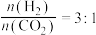 时,
时, 平衡转化率随温度的变化如图1所示,乙烯选择性随温度的变化如图2所示[乙烯选择性
平衡转化率随温度的变化如图1所示,乙烯选择性随温度的变化如图2所示[乙烯选择性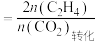 ]:
]: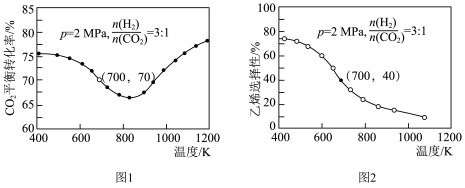
 平衡转化率随温度升高出现先下降后升高可能的原因是
平衡转化率随温度升高出现先下降后升高可能的原因是②700K时,反应i的

(5)关于上述反应,下列说法正确的是_______(填选项字母)。
A.提高投料比 , , 的平衡转化率减小 的平衡转化率减小 |
| B.使用高效催化剂可提高平衡时乙烯的体积分数 |
| C.若在恒容、绝热容器中进行,温度不变则反应达到平衡 |
D.体系内 比值不变反应达到平衡状态 比值不变反应达到平衡状态 |
您最近一年使用:0次
名校
解题方法
6 . 二氧化碳加氢制甲醇的过程中的主要反应(忽略其他副反应)为:
①
②
225℃、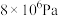 下,将一定比例
下,将一定比例 、
、 混合气匀速通过装有催化剂的绝热反应管。装置及
混合气匀速通过装有催化剂的绝热反应管。装置及 、
、 、
、 位点处(相邻位点距离相同)的气体温度、
位点处(相邻位点距离相同)的气体温度、 和
和 的体积分数如图所示。下列说法不正确的是
的体积分数如图所示。下列说法不正确的是
①

②

225℃、
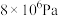 下,将一定比例
下,将一定比例 、
、 混合气匀速通过装有催化剂的绝热反应管。装置及
混合气匀速通过装有催化剂的绝热反应管。装置及 、
、 、
、 位点处(相邻位点距离相同)的气体温度、
位点处(相邻位点距离相同)的气体温度、 和
和 的体积分数如图所示。下列说法不正确的是
的体积分数如图所示。下列说法不正确的是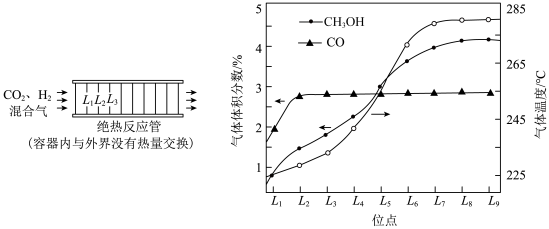
A.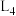 处与 处与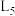 处反应①的平衡常数 处反应①的平衡常数 不相等 不相等 |
B.反应②的焓变 |
C.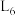 处的 处的 的体积分数小于 的体积分数小于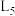 处 处 |
D.混合气从起始到通过 处, 处, 的生成速率大于 的生成速率大于 的生成速率 的生成速率 |
您最近一年使用:0次
7 . 在一定温度下,向体积固定的密闭容器中加入足量的 和
和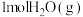 ,起始压强为
,起始压强为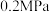 时,发生下列反应生成水煤气:
时,发生下列反应生成水煤气:
I.
II.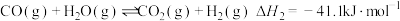
反应平衡时, 的转化率为50%,CO的物质的量为
的转化率为50%,CO的物质的量为 。反应I的平衡常数
。反应I的平衡常数 为(以分压表示,分压=总压×物质的量分数)。
为(以分压表示,分压=总压×物质的量分数)。
 和
和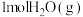 ,起始压强为
,起始压强为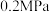 时,发生下列反应生成水煤气:
时,发生下列反应生成水煤气:I.

II.
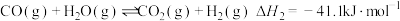
反应平衡时,
 的转化率为50%,CO的物质的量为
的转化率为50%,CO的物质的量为 。反应I的平衡常数
。反应I的平衡常数 为(以分压表示,分压=总压×物质的量分数)。
为(以分压表示,分压=总压×物质的量分数)。A.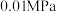 | B. | C.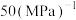 | D.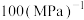 |
您最近一年使用:0次
8 .  是一种新型硝化剂,在恒温恒容条件下发生下列反应:
是一种新型硝化剂,在恒温恒容条件下发生下列反应: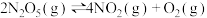
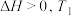 温度下的部分实验数据如下:
温度下的部分实验数据如下:
下列说法不正确的是
 是一种新型硝化剂,在恒温恒容条件下发生下列反应:
是一种新型硝化剂,在恒温恒容条件下发生下列反应: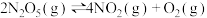
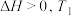 温度下的部分实验数据如下:
温度下的部分实验数据如下:| t/s | 0 | 500 | 1000 | 1500 |
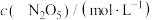 | 5.00 | 3.52 | 2.50 | 2.50 |
A.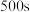 内 内 分解速率为 分解速率为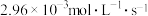 |
B. 温度下的平衡常数为 温度下的平衡常数为 ,1000s时 ,1000s时 的转化率为 的转化率为 |
C.其他条件不变, 温度下反应到 温度下反应到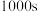 时测得 时测得 的浓度为 的浓度为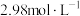 ,则 ,则 |
D.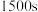 时,再充入 时,再充入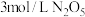 ,重新达到平衡后 ,重新达到平衡后 的转化率减小 的转化率减小 |
您最近一年使用:0次
真题
解题方法
9 . 羟基磷酸钙
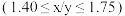 是骨骼石灰和牙釉质的主要成分。某课题组按照下述步骤进行其制备探索:在75℃下向由一定量
是骨骼石灰和牙釉质的主要成分。某课题组按照下述步骤进行其制备探索:在75℃下向由一定量 粉末配制的含有分散剂的浆液中,边搅拌边滴加计算量的稀
粉末配制的含有分散剂的浆液中,边搅拌边滴加计算量的稀 ,滴加完成后继续搅拌一段时间。冷至室温固液分离,烘干固体得纳米级微粉产品。制备依据的代表反应式为:
,滴加完成后继续搅拌一段时间。冷至室温固液分离,烘干固体得纳米级微粉产品。制备依据的代表反应式为: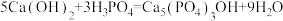 ,装置如图所示(固定器具已省略)。
,装置如图所示(固定器具已省略)。
(1)装置图中,安装不当的是_______ (填仪器标号)
(2)使用冷凝管的目的是_______ ,冷凝水进水口为_______ (填序号),干燥管中熟石灰用于吸收_______ (填化学式)。
(3)实验中使用水浴加热,其优点为_______ 、_______ 。
(4)投料时应使用新制 粉末,以降低杂质
粉末,以降低杂质_______ (填化学式)对实验的影响。
(5)完成反应后,可以保持产品组成稳定的固液分离方式有_______ 、_______ (填标号)。
a.倾倒 b.常压过滤 c.减压过滤 d.离心分离
(6)实验中以题述加料方式所得产品中 。某次实验将
。某次实验将 浆液滴入稀
浆液滴入稀 得到的产品中
得到的产品中 。造成这种结果差异的原因是
。造成这种结果差异的原因是_______ 。

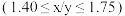 是骨骼石灰和牙釉质的主要成分。某课题组按照下述步骤进行其制备探索:在75℃下向由一定量
是骨骼石灰和牙釉质的主要成分。某课题组按照下述步骤进行其制备探索:在75℃下向由一定量 粉末配制的含有分散剂的浆液中,边搅拌边滴加计算量的稀
粉末配制的含有分散剂的浆液中,边搅拌边滴加计算量的稀 ,滴加完成后继续搅拌一段时间。冷至室温固液分离,烘干固体得纳米级微粉产品。制备依据的代表反应式为:
,滴加完成后继续搅拌一段时间。冷至室温固液分离,烘干固体得纳米级微粉产品。制备依据的代表反应式为: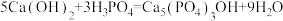 ,装置如图所示(固定器具已省略)。
,装置如图所示(固定器具已省略)。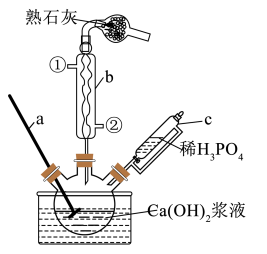
(1)装置图中,安装不当的是
(2)使用冷凝管的目的是
(3)实验中使用水浴加热,其优点为
(4)投料时应使用新制
 粉末,以降低杂质
粉末,以降低杂质(5)完成反应后,可以保持产品组成稳定的固液分离方式有
a.倾倒 b.常压过滤 c.减压过滤 d.离心分离
(6)实验中以题述加料方式所得产品中
 。某次实验将
。某次实验将 浆液滴入稀
浆液滴入稀 得到的产品中
得到的产品中 。造成这种结果差异的原因是
。造成这种结果差异的原因是
您最近一年使用:0次
名校
10 . 下列装置图或曲线图与对应的叙述相符的是
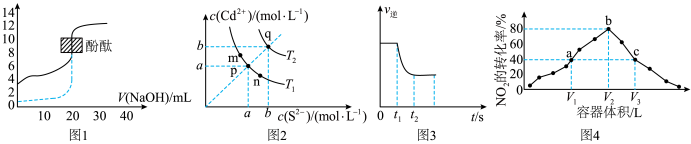
A.如图1所示,用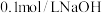 溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
B.图2为硫化镉( )的沉淀溶解平衡曲线图,图中各点对应的 )的沉淀溶解平衡曲线图,图中各点对应的 的关系为: 的关系为: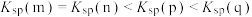 |
C.图3表示 的 的 随时间变化曲线,由图知 随时间变化曲线,由图知 时刻可能减小了容器内的反应物浓度 时刻可能减小了容器内的反应物浓度 |
D.图4表示温度为 ,体积不等的恒容密闭容器中发生反应 ,体积不等的恒容密闭容器中发生反应 ,相同时间测得各容器中 ,相同时间测得各容器中 的转化率与容器体积的关系,图中 的转化率与容器体积的关系,图中 点所示条件下, 点所示条件下, |
您最近一年使用:0次



