1 . 银及其化合物在多种化学反应中都有重要作用。
(1)工业上常用 为催化剂氧化乙烯制备环氧乙烷(
为催化剂氧化乙烯制备环氧乙烷(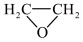 ,简称
,简称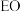 );
);
反应方程式为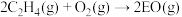 (反应a)
(反应a)
①银和铜位于同一族相邻周期,基态 原子的价层电子排布式为:
原子的价层电子排布式为:_____ 。
②已知: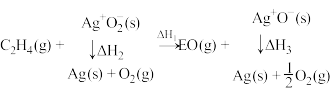
则反应a的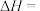
_____ 。
③关于反应a,下列说法正确的是_____ 。
A.加入银单质能降低该反应的活化能和焓变
B.因氧气并不直接与乙烯反应,故改变氧气浓度对反应无影响
C.移出部分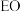 可使平衡正向移动,从而提高产率
可使平衡正向移动,从而提高产率
D.恒温恒容容器中,通入一定量的 气可增大压强,但乙烯的平衡转化率不变
气可增大压强,但乙烯的平衡转化率不变
(2)我国科学家报道了一种高效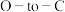 的替换反应,可在温和条件下将环氧化物快速转化为环丙烷结构。一种脱氧/环加成串联反应机理如图,其中的催化剂为
的替换反应,可在温和条件下将环氧化物快速转化为环丙烷结构。一种脱氧/环加成串联反应机理如图,其中的催化剂为_____ (填图中字母),反应物A和C消耗的物质的量之比为_____ 。(已知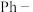 代表苯基)
代表苯基) 在
在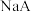 (A为M或N)溶液中的溶解状况。
(A为M或N)溶液中的溶解状况。
a.已知: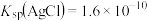 ;
;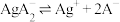
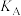
b.向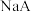 溶液中加入足量
溶液中加入足量 固体,发生反应:
固体,发生反应: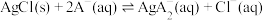 。
。
测得平衡时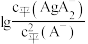 随
随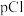 的变化曲线如图
的变化曲线如图 ,不考虑
,不考虑 的其它存在形式}。
的其它存在形式}。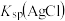
_____ 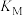 ,
,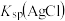
_____  。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
②计算 在
在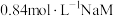 溶液中的溶解度(用物质的量浓度表示,写出计算过程,结果保留两位有效数字)
溶液中的溶解度(用物质的量浓度表示,写出计算过程,结果保留两位有效数字)_____ 。
(1)工业上常用
 为催化剂氧化乙烯制备环氧乙烷(
为催化剂氧化乙烯制备环氧乙烷( ,简称
,简称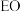 );
);反应方程式为
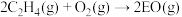 (反应a)
(反应a)①银和铜位于同一族相邻周期,基态
 原子的价层电子排布式为:
原子的价层电子排布式为:②已知:
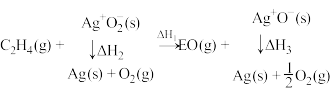
则反应a的
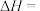
③关于反应a,下列说法正确的是
A.加入银单质能降低该反应的活化能和焓变
B.因氧气并不直接与乙烯反应,故改变氧气浓度对反应无影响
C.移出部分
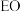 可使平衡正向移动,从而提高产率
可使平衡正向移动,从而提高产率D.恒温恒容容器中,通入一定量的
 气可增大压强,但乙烯的平衡转化率不变
气可增大压强,但乙烯的平衡转化率不变(2)我国科学家报道了一种高效
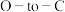 的替换反应,可在温和条件下将环氧化物快速转化为环丙烷结构。一种脱氧/环加成串联反应机理如图,其中的催化剂为
的替换反应,可在温和条件下将环氧化物快速转化为环丙烷结构。一种脱氧/环加成串联反应机理如图,其中的催化剂为 代表苯基)
代表苯基)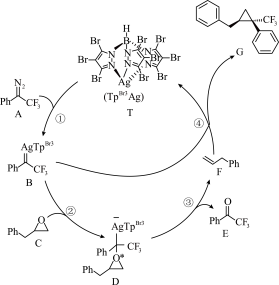
 在
在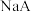 (A为M或N)溶液中的溶解状况。
(A为M或N)溶液中的溶解状况。a.已知:
 ;
;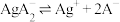
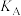
b.向
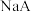 溶液中加入足量
溶液中加入足量 固体,发生反应:
固体,发生反应: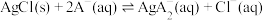 。
。测得平衡时
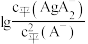 随
随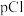 的变化曲线如图
的变化曲线如图 ,不考虑
,不考虑 的其它存在形式}。
的其它存在形式}。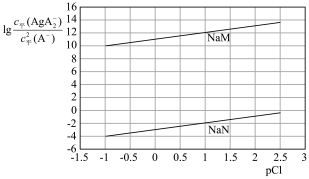
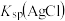
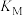 ,
,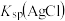
 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)②计算
 在
在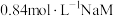 溶液中的溶解度(用物质的量浓度表示,写出计算过程,结果保留两位有效数字)
溶液中的溶解度(用物质的量浓度表示,写出计算过程,结果保留两位有效数字)
您最近一年使用:0次
解题方法
2 .  可用于催化剂载体及功能材料的制备。某独居石矿石主要成分为
可用于催化剂载体及功能材料的制备。某独居石矿石主要成分为 ,含有
,含有 、
、 等杂质。以该矿石为原料制备
等杂质。以该矿石为原料制备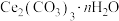 的工艺流程如下图所示(不考虑其它杂质对流程的影响):
的工艺流程如下图所示(不考虑其它杂质对流程的影响):___________ (填化学式),若在实验室进行“焙烧”时宜采用的仪器为___________ 。
a.玻璃仪器 b.铅制仪器 c.聚四氟乙烯仪器
(2)滤渣1的主要成分有 、
、___________ (填化学式),“加入氨水调pH”时发生的主要反应的离子方程式为:___________ 。
(3)“沉铈”过程中会有一种气体产生,该气体是___________ (填化学式)。已知 溶液显弱碱性,则
溶液显弱碱性,则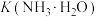 、
、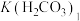 、
、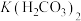 三者相对大小是
三者相对大小是___________ 。
(4) 与
与 、
、 在高温下反应可得到用于制备电极材料的
在高温下反应可得到用于制备电极材料的 ,写出相应的化学方程式
,写出相应的化学方程式___________ 。
(5)已知常温下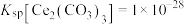 、
、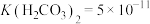 ,若
,若 恰好沉淀完全
恰好沉淀完全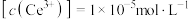 时溶液的
时溶液的 ,则溶液中
,则溶液中 为
为___________  。
。
 可用于催化剂载体及功能材料的制备。某独居石矿石主要成分为
可用于催化剂载体及功能材料的制备。某独居石矿石主要成分为 ,含有
,含有 、
、 等杂质。以该矿石为原料制备
等杂质。以该矿石为原料制备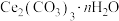 的工艺流程如下图所示(不考虑其它杂质对流程的影响):
的工艺流程如下图所示(不考虑其它杂质对流程的影响):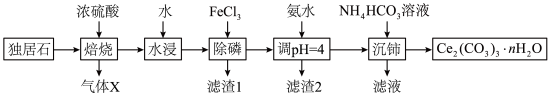
a.玻璃仪器 b.铅制仪器 c.聚四氟乙烯仪器
(2)滤渣1的主要成分有
 、
、(3)“沉铈”过程中会有一种气体产生,该气体是
 溶液显弱碱性,则
溶液显弱碱性,则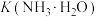 、
、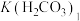 、
、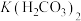 三者相对大小是
三者相对大小是(4)
 与
与 、
、 在高温下反应可得到用于制备电极材料的
在高温下反应可得到用于制备电极材料的 ,写出相应的化学方程式
,写出相应的化学方程式(5)已知常温下
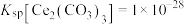 、
、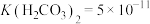 ,若
,若 恰好沉淀完全
恰好沉淀完全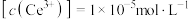 时溶液的
时溶液的 ,则溶液中
,则溶液中 为
为 。
。
您最近一年使用:0次
3 . 已知室温下,一元弱酸 溶液中除电离平衡外,还存在平衡
溶液中除电离平衡外,还存在平衡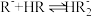
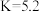 。下列说法一定正确的是
。下列说法一定正确的是
 溶液中除电离平衡外,还存在平衡
溶液中除电离平衡外,还存在平衡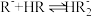
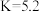 。下列说法一定正确的是
。下列说法一定正确的是A. 的 的 溶液稀释10倍后 溶液稀释10倍后 , ,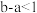 ,由此可以判定 ,由此可以判定 是弱酸 是弱酸 |
B. 的电离度随 的电离度随 浓度的增大而减小 浓度的增大而减小 |
C.向 溶液中加入一定量氨水,所得溶液 溶液中加入一定量氨水,所得溶液 时,存在 时,存在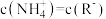 |
D.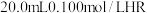 溶液中滴加 溶液中滴加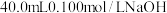 溶液时,存在 溶液时,存在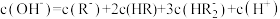 |
您最近一年使用:0次
4 . Q、X、Y、Z是原子序数依次增大的短周期主族元素。Q的最外层电子数是内层的2倍,X的简单氢化物与Y单质是工业制备硝酸的基本原料,Y、Z形成的离子化合物可作漂白剂。下列说法正确的是
A.简单离子半径: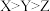 | B.最高价氧化物对应水化物的酸性: |
C.简单氢化物沸点: | D.X、Y、Z形成的盐溶液一定呈中性 |
您最近一年使用:0次
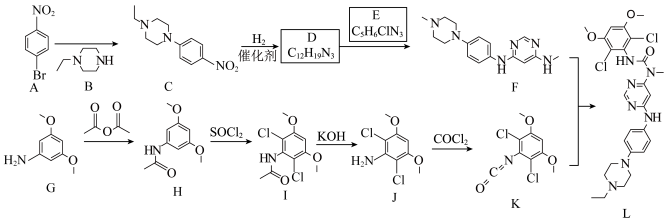
5 . 英菲替尼(化合物L)是治疗胆管癌的新型药物,其合成路线如下。_______ 。
(2)E的结构简式为_______ 。
(3)由G→J的转化过程可知,G转化为H的目的是_______ 。
(4)H的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______ 。碱性条件水解后酸化得到两种产物,其中一种为 —氨基酸且含有手性碳原子;另一产物分子中不同化学环境的氢原子数目比为1:2
—氨基酸且含有手性碳原子;另一产物分子中不同化学环境的氢原子数目比为1:2
(5)1,3—二苯基脲(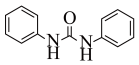 )是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3—二苯基脲的合成路线
)是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3—二苯基脲的合成路线_______ (无机试剂任选)。
(2)E的结构简式为
(3)由G→J的转化过程可知,G转化为H的目的是
(4)H的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
 —氨基酸且含有手性碳原子;另一产物分子中不同化学环境的氢原子数目比为1:2
—氨基酸且含有手性碳原子;另一产物分子中不同化学环境的氢原子数目比为1:2(5)1,3—二苯基脲(
 )是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3—二苯基脲的合成路线
)是某些药物分子的重要结构单元。参照上述合成路线,写出以苯为原料制备1,3—二苯基脲的合成路线
您最近一年使用:0次
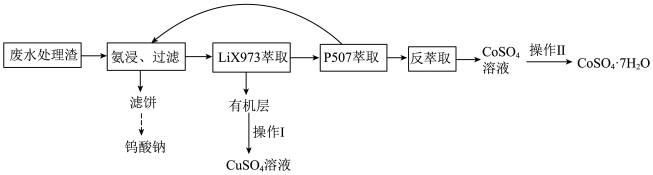
6 . 对废水进行处理可有效利用金属资源。某废水处理渣的主要元素组成为铁、钴、铜、钨,其一种回收利用工艺的部分流程如图所示:
ⅱ、氨浸时,氨与Cu2+、Co2+、Co3+等离子可形成稳定配合物;
ⅲ、Kb(NH3·H2O)=10-4.7
ⅳ、萃取剂LiX973的萃取原理为Cu2+(aq)+2HR CuR2+2H+(aq),P507的萃取原理与其相似。
CuR2+2H+(aq),P507的萃取原理与其相似。
回答下列问题:
(1)基态Co2+的价层电子排布式为_____ 。
(2)处理渣中的Cu(OH)2在“氨浸”步骤中发生反应的离子方程式为_____ 。
(3)常温下,pH=12的氨性溶液中,
_____ 1(填“>”“<”或“=”)。
(4)在一定条件下,氨浸时间超过5h时,钴、铜浸出率不再升高,反而有所下降,原因可能是_____ 。
(5)“反萃取”步骤中加入的试剂是_____ (填化学式);大颗粒硫酸钴晶体是制备锂离子电池的原材料,“操作Ⅱ”的结晶过程中更利于制得大颗粒晶体的操作为_____ (任答一点)。
(6)我国科学工作者利用晶胞结构如图1所示的氮化钴掺杂Cu获得有高效催化性能新物质,形成了如图2所示的结构单元。_____ 。
②)若NA为阿伏加德罗常数的值,则由图2所示单元结构形成的晶胞的密度为_____ g▪cm-3(用含a、NA的代数式表示)。
ⅱ、氨浸时,氨与Cu2+、Co2+、Co3+等离子可形成稳定配合物;
ⅲ、Kb(NH3·H2O)=10-4.7
ⅳ、萃取剂LiX973的萃取原理为Cu2+(aq)+2HR
 CuR2+2H+(aq),P507的萃取原理与其相似。
CuR2+2H+(aq),P507的萃取原理与其相似。回答下列问题:
(1)基态Co2+的价层电子排布式为
(2)处理渣中的Cu(OH)2在“氨浸”步骤中发生反应的离子方程式为
(3)常温下,pH=12的氨性溶液中,

(4)在一定条件下,氨浸时间超过5h时,钴、铜浸出率不再升高,反而有所下降,原因可能是
(5)“反萃取”步骤中加入的试剂是
(6)我国科学工作者利用晶胞结构如图1所示的氮化钴掺杂Cu获得有高效催化性能新物质,形成了如图2所示的结构单元。
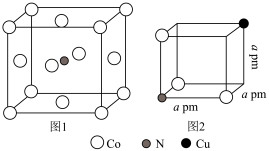
②)若NA为阿伏加德罗常数的值,则由图2所示单元结构形成的晶胞的密度为
您最近一年使用:0次
今日更新
|
107次组卷
|
2卷引用:广东省多校2025届高三上学期摸底联考化学试题
解题方法
7 . SiCl4是生产多晶硅的副产物。可以利用SiCl4对废弃的锂电池正极材料LiCoO2进行氯化处理、进而回收Li、Co等金属,部分流程如下:
(1)烧渣是LiCl、CoCl2和SiO2的混合物,请写出“500℃焙烧”的化学方程式_______ 。
(2)“500℃焙烧”后剩余的SiCl4应先除去,否则水浸时会产生大量烟雾。SiCl4发生水解时的机理及Si原子的杂化方式如下图:
(3) 可以发生自耦电离:
可以发生自耦电离: ,其平衡常数的数值K=
,其平衡常数的数值K=_______ 。
(4)“沉钴”时,滤液1与NaHCO3溶液混合时的加料方式是_______ 。
(5)Li2CO3的溶解度随温度变化如下图所示。为了获得更多的Li2CO3,加入Na2CO3溶液后的操作X为_______ 、洗涤、干燥。_______ (写出计算推理过程)。

(1)烧渣是LiCl、CoCl2和SiO2的混合物,请写出“500℃焙烧”的化学方程式
(2)“500℃焙烧”后剩余的SiCl4应先除去,否则水浸时会产生大量烟雾。SiCl4发生水解时的机理及Si原子的杂化方式如下图:
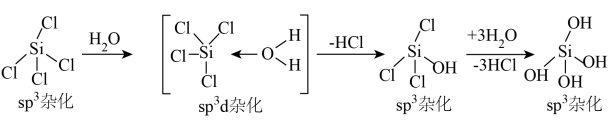
| A.Si-C1键极性更大 | B.Si的原子半径更大 | C.Si-C1键键能更大 | D.Si有更多的价层轨道 |
(3)
 可以发生自耦电离:
可以发生自耦电离: ,其平衡常数的数值K=
,其平衡常数的数值K=(4)“沉钴”时,滤液1与NaHCO3溶液混合时的加料方式是
(5)Li2CO3的溶解度随温度变化如下图所示。为了获得更多的Li2CO3,加入Na2CO3溶液后的操作X为
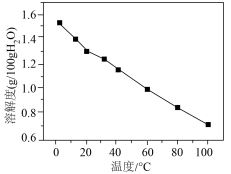

您最近一年使用:0次
8 . 清洁能源的开发利用是实现“双碳”目标的重要途径,乙醇-水催化重整可获得H2,其主要反应为:
①C2H5OH(g)+3H2O(g) 2CO2(g)+6H2(g) ΔH=+173.3kJ·mol-1;
2CO2(g)+6H2(g) ΔH=+173.3kJ·mol-1;
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.1kJ·mol-1。
CO(g)+H2O(g) ΔH=+41.1kJ·mol-1。
在体积为1L的密闭容器中充入1molC2H5OH(g)和3molH2O(g)发生上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如题图所示。已知:①CO的选择性=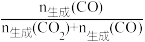 ×100%。②700℃时,反应②的平衡常数为1。下列说法
×100%。②700℃时,反应②的平衡常数为1。下列说法不正确 的是
①C2H5OH(g)+3H2O(g)
 2CO2(g)+6H2(g) ΔH=+173.3kJ·mol-1;
2CO2(g)+6H2(g) ΔH=+173.3kJ·mol-1;②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.1kJ·mol-1。
CO(g)+H2O(g) ΔH=+41.1kJ·mol-1。在体积为1L的密闭容器中充入1molC2H5OH(g)和3molH2O(g)发生上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如题图所示。已知:①CO的选择性=
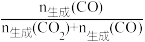 ×100%。②700℃时,反应②的平衡常数为1。下列说法
×100%。②700℃时,反应②的平衡常数为1。下列说法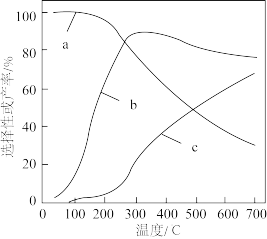
| A.曲线a表示平衡时CO2的选择性 |
| B.及时分离出CO2能提高平衡时H2产率 |
| C.700℃时,平衡体系中:n(H2)<n(H2O) |
D.300℃以后,随着温度的升高,平衡时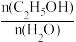 减小 减小 |
您最近一年使用:0次
名校
解题方法
9 . 有机物H是有机合成中的一种重要中间体,合成H的一种路线如图所示: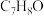 。
。
②B与银氨溶液反应,有单质银生成。
(1)H中官能团的名称为___________ 。
(2)E→F的反应类型为___________ ,X的结构简式为___________ 。
(3)A→C的化学方程式为___________ 。
(4)D→E转化中第①步反应的化学方程式为___________ 。
(5)G与乙醇发生酯化反应生成有机物Y,符合下列条件的Y的同分异构体___________ 种;其中的一种结构简式为:___________ 。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出
②含有碳碳三键,且碳碳三键与苯环直接相连
③苯环上只有三种取代基
④核磁共振氢谱显示有4组峰,且峰面积之比为6∶2∶1∶1
(6)参照上述合成路线,设计以丙烯为原料合成化合物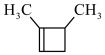 的路线如下:(部分反应条件已略去)。其中M和N的结构简式为
的路线如下:(部分反应条件已略去)。其中M和N的结构简式为___________ 和___________ 。
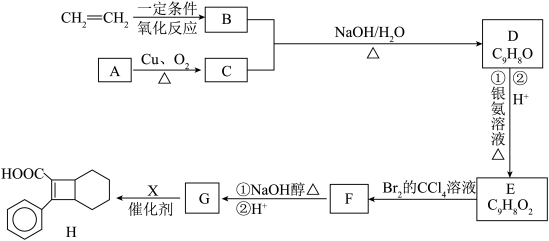
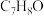 。
。②B与银氨溶液反应,有单质银生成。
③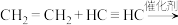
 。
。
(1)H中官能团的名称为
(2)E→F的反应类型为
(3)A→C的化学方程式为
(4)D→E转化中第①步反应的化学方程式为
(5)G与乙醇发生酯化反应生成有机物Y,符合下列条件的Y的同分异构体
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出

②含有碳碳三键,且碳碳三键与苯环直接相连
③苯环上只有三种取代基
④核磁共振氢谱显示有4组峰,且峰面积之比为6∶2∶1∶1
(6)参照上述合成路线,设计以丙烯为原料合成化合物
 的路线如下:(部分反应条件已略去)。其中M和N的结构简式为
的路线如下:(部分反应条件已略去)。其中M和N的结构简式为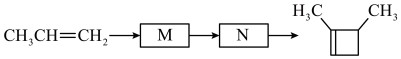
您最近一年使用:0次
名校
解题方法
10 . 无水亚硫酸钠( )广泛应用于电化学工业中阳极泥贵金属的提炼。但久置的无水
)广泛应用于电化学工业中阳极泥贵金属的提炼。但久置的无水 容易氧化变质,其纯度的测定方法有多种,现列出如下几种常见的方法:
容易氧化变质,其纯度的测定方法有多种,现列出如下几种常见的方法:
Ⅰ.固体质量分析法:取久置的无水 固体样品m g于试管中加水溶解,向试管中滴入过量的
固体样品m g于试管中加水溶解,向试管中滴入过量的 溶液,再经过滤、洗涤、干燥、称量,得到固体n g,经分析计算即可得到
溶液,再经过滤、洗涤、干燥、称量,得到固体n g,经分析计算即可得到 纯度。
纯度。
(1)请用化学方程式表示 变质的主要原因
变质的主要原因_______ 。
(2)确认 溶液已经过量的实验操作是
溶液已经过量的实验操作是_______ 。
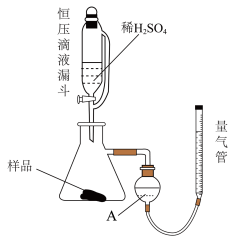
Ⅱ.气体体积分析法:
②调整A与量气管液面相平,读量气管中液体体积为 。
。
③打开恒压滴液漏斗下端的活塞,加入过量的 稀硫酸,让其充分反应。
稀硫酸,让其充分反应。
④恢复至原温度并调整量气管液面,读量气管中液体体积为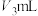 (已知
(已知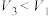 )。
)。
请回答下列问题:
(3)A的仪器名称为_______ 。
(4)相比普通的分液漏斗,恒压滴液漏斗在该实验中的优点是_______(选填“A、B、C、D”)。
(5)该实验条件为标准状况,则测得 的物质的量为
的物质的量为_______ mol(选择合适的字母符号来表示)。
Ⅲ.滴定法:
①称取2.10 g样品于锥形瓶中,加入 酸性
酸性 溶液20.00 mL,塞紧塞子,振荡让其充分反应。
溶液20.00 mL,塞紧塞子,振荡让其充分反应。
②用 的
的 溶液滴定过量的酸性
溶液滴定过量的酸性 溶液。
溶液。
③重复①②两组实验三次,平均消耗 溶液30.00 mL。
溶液30.00 mL。
请回答下列问题:
(6)第②步中发生的离子反应方程式为_______ 。
(7)该无水 样品的纯度(质量百分数)为
样品的纯度(质量百分数)为_______ (保留到小数点后两位)。
 )广泛应用于电化学工业中阳极泥贵金属的提炼。但久置的无水
)广泛应用于电化学工业中阳极泥贵金属的提炼。但久置的无水 容易氧化变质,其纯度的测定方法有多种,现列出如下几种常见的方法:
容易氧化变质,其纯度的测定方法有多种,现列出如下几种常见的方法:Ⅰ.固体质量分析法:取久置的无水
 固体样品m g于试管中加水溶解,向试管中滴入过量的
固体样品m g于试管中加水溶解,向试管中滴入过量的 溶液,再经过滤、洗涤、干燥、称量,得到固体n g,经分析计算即可得到
溶液,再经过滤、洗涤、干燥、称量,得到固体n g,经分析计算即可得到 纯度。
纯度。(1)请用化学方程式表示
 变质的主要原因
变质的主要原因(2)确认
 溶液已经过量的实验操作是
溶液已经过量的实验操作是Ⅱ.气体体积分析法:
②调整A与量气管液面相平,读量气管中液体体积为
 。
。③打开恒压滴液漏斗下端的活塞,加入过量的
 稀硫酸,让其充分反应。
稀硫酸,让其充分反应。④恢复至原温度并调整量气管液面,读量气管中液体体积为
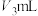 (已知
(已知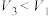 )。
)。请回答下列问题:
(3)A的仪器名称为
(4)相比普通的分液漏斗,恒压滴液漏斗在该实验中的优点是_______(选填“A、B、C、D”)。
| A.可以起到冷凝回流的作用 | B.方便检验装置的气密性 |
| C.使漏斗中液体顺利流下 | D.减小加入液体体积对测量气体体积的误差 |
(5)该实验条件为标准状况,则测得
 的物质的量为
的物质的量为Ⅲ.滴定法:
①称取2.10 g样品于锥形瓶中,加入
 酸性
酸性 溶液20.00 mL,塞紧塞子,振荡让其充分反应。
溶液20.00 mL,塞紧塞子,振荡让其充分反应。②用
 的
的 溶液滴定过量的酸性
溶液滴定过量的酸性 溶液。
溶液。③重复①②两组实验三次,平均消耗
 溶液30.00 mL。
溶液30.00 mL。请回答下列问题:
(6)第②步中发生的离子反应方程式为
(7)该无水
 样品的纯度(质量百分数)为
样品的纯度(质量百分数)为
您最近一年使用:0次



