名校
1 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备 ,然后
,然后 再与CaCN2合成
再与CaCN2合成 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。 易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
回答下列问题:
(1)实验前先检查装置气密性,操作为:①在E中加水至浸没导管末端,……;②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;③一段时间后,E处导管末端形成一段水柱,且高度不变。将操作①补充完整_______ 。
(2)检查气密性后加入药品,装置A中的试剂最佳组合是_______ (填字母),打开K2。
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
装置B中盛装的试剂为_______ 。待A中反应结束后关闭K2,打开K1通N2一段时间,目的是_______ 。
(3)撤走搅拌器,打开K3,水浴加热D处三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是_______ ,D处合成硫脲的化学方程式为_______ 。
(4)将装置D中液体过滤后,结晶得到粗产品。测定粗产品中硫脲纯度:称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol⋅L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液VmL。
①硫脲 中硫元素的化合价为
中硫元素的化合价为_______ 价。
②滴定时,硫脲转化为CO2、N2、 的离子方程式为
的离子方程式为_______ 。
③样品中硫脲的质量分数为_______ (用含“m,c、V”的式子表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备 ,然后
,然后 再与CaCN2合成
再与CaCN2合成 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。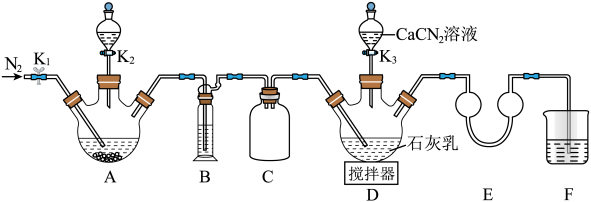
 易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。回答下列问题:
(1)实验前先检查装置气密性,操作为:①在E中加水至浸没导管末端,……;②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;③一段时间后,E处导管末端形成一段水柱,且高度不变。将操作①补充完整
(2)检查气密性后加入药品,装置A中的试剂最佳组合是
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
装置B中盛装的试剂为
(3)撤走搅拌器,打开K3,水浴加热D处三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是
(4)将装置D中液体过滤后,结晶得到粗产品。测定粗产品中硫脲纯度:称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol⋅L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液VmL。
①硫脲
 中硫元素的化合价为
中硫元素的化合价为②滴定时,硫脲转化为CO2、N2、
 的离子方程式为
的离子方程式为③样品中硫脲的质量分数为
您最近一年使用:0次
真题
2 . 在水溶液中, 可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与
可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与 形成配离子达平衡时,
形成配离子达平衡时, 与
与 的关系如图。
的关系如图。
 可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与
可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与 形成配离子达平衡时,
形成配离子达平衡时, 与
与 的关系如图。
的关系如图。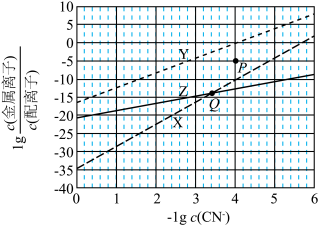
A.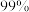 的X、Y转化为配离子时,两溶液中 的X、Y转化为配离子时,两溶液中 的平衡浓度: 的平衡浓度: |
B.向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时 |
C.由Y和Z分别制备等物质的量的配离子时,消耗 的物质的量: 的物质的量: |
| D.若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率 |
您最近一年使用:0次
名校
3 . 已知常温下水溶液中 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如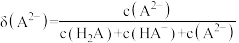 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中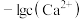 和
和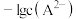 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
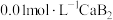 溶液,下列说法错误的是
溶液,下列说法错误的是
 、
、 、
、 、
、 、
、 的分布分数
的分布分数 如[如
如[如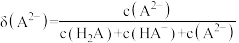 ]随
]随 变化曲线如图1所示,溶液中
变化曲线如图1所示,溶液中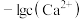 和
和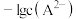 关系如图2所示,用
关系如图2所示,用 的
的 溶液滴定
溶液滴定
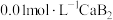 溶液,下列说法错误的是
溶液,下列说法错误的是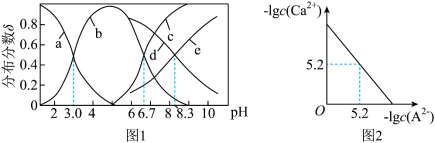
A.曲线b表示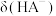 |
B. 溶液中存在: 溶液中存在: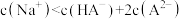 |
C.反应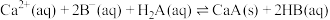 的平衡常数 的平衡常数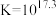 |
D.滴定过程中始终存在: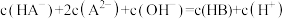 |
您最近一年使用:0次
7日内更新
|
127次组卷
|
2卷引用:2024届河南省信阳市高三下学期高考考前押题理科综合试卷-高中化学
4 . 阿来替尼(Alectinib)是2018年9月在中国、美国、欧盟同时被批准使用的“肺癌最强靶向药”,它能有效控制肺癌转移,有效率达100%。其最新中国专利合成路线如下
请回答:
(1)化合物B的含氧官能团的名称______ 。
(2)下列说法正确的是______。
(3)化合物 与
与 反应生成化合物
反应生成化合物 和
和______ 。
(4)三氟甲基磺酸䣷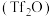 常用于磺酸酯类合成,写出化合物
常用于磺酸酯类合成,写出化合物 与
与 生成Alectinib反应的方程式:
生成Alectinib反应的方程式:____________ 。
(5)写出满足下列条件 的同分异构体的结构简式
的同分异构体的结构简式______ 。
①分子中含有1个苯环,2个羟基;
②有5种不同化学环境的氢原子。
(6)像化合物A一样的结构称为吲哚环结构,以下步骤可合成吲哚环结构:
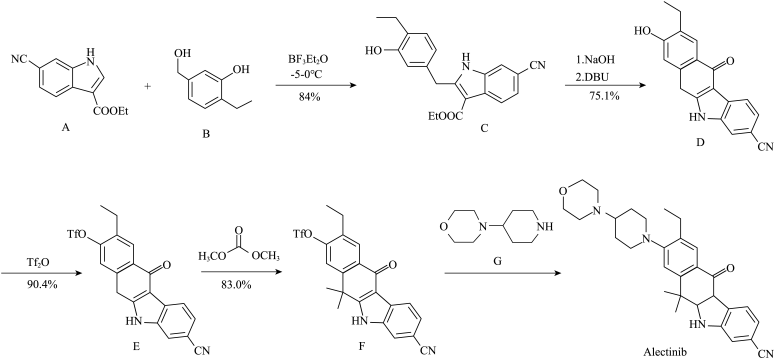
请回答:
(1)化合物B的含氧官能团的名称
(2)下列说法正确的是______。
A.由 转化为 转化为 的过程中,有一步骤是水解反应 的过程中,有一步骤是水解反应 |
B.则化合物 的分子式是 的分子式是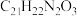 |
| C.化合物D为既有弱酸性又有弱碱性的两性氧化物 |
D.化合物 转化为化合物 转化为化合物 的目的是保护官能团 的目的是保护官能团 |
(3)化合物
 与
与 反应生成化合物
反应生成化合物 和
和(4)三氟甲基磺酸䣷
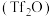 常用于磺酸酯类合成,写出化合物
常用于磺酸酯类合成,写出化合物 与
与 生成Alectinib反应的方程式:
生成Alectinib反应的方程式:(5)写出满足下列条件
 的同分异构体的结构简式
的同分异构体的结构简式①分子中含有1个苯环,2个羟基;
②有5种不同化学环境的氢原子。
(6)像化合物A一样的结构称为吲哚环结构,以下步骤可合成吲哚环结构:
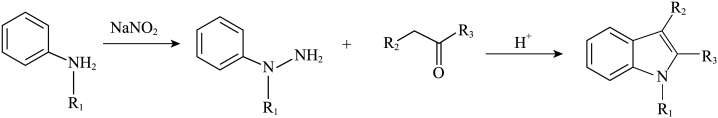
结合以上相关信息,利用硝基苯、1-丙醇设计合成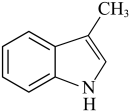 路线(无机试剂任用,合成路线例见本题题干):
路线(无机试剂任用,合成路线例见本题题干):
您最近一年使用:0次
解题方法
5 . 常温下 与
与 的反应为
的反应为 ,当加入
,当加入 时生成更难溶的Ca5(PO4)3F,氟磷比
时生成更难溶的Ca5(PO4)3F,氟磷比 为1∶10、10∶1的两种水溶液中加入过量
为1∶10、10∶1的两种水溶液中加入过量 ,平衡时
,平衡时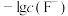 、
、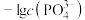 与
与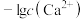 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是
 与
与 的反应为
的反应为 ,当加入
,当加入 时生成更难溶的Ca5(PO4)3F,氟磷比
时生成更难溶的Ca5(PO4)3F,氟磷比 为1∶10、10∶1的两种水溶液中加入过量
为1∶10、10∶1的两种水溶液中加入过量 ,平衡时
,平衡时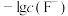 、
、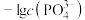 与
与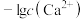 的关系如图。下列说法错误的是
的关系如图。下列说法错误的是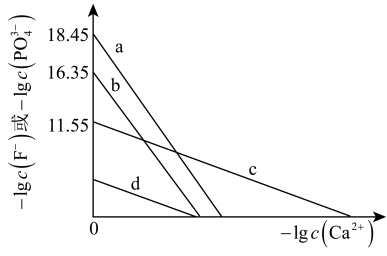
A.曲线a、b均表示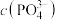 与 与 的关系,氟磷比a>b 的关系,氟磷比a>b |
B. |
C.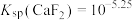 |
D.将氟磷比由10∶1提高至20∶1可有效降低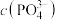 |
您最近一年使用:0次
名校
6 . 高纯镓广泛用于半导体、光电材料等领域。可以利用炼锌渣(主要含ZnO、CuO、 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应: 。
。
③室温时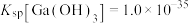 ;
;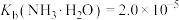 。
。
④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1) 的价层电子排布式为
的价层电子排布式为_____ ,1mol 中含有σ键的物质的量为
中含有σ键的物质的量为_____ 。
(2)黄钠铁矾的化学式为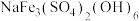 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式_____ 。
(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成 胶体,不容易过滤;②
胶体,不容易过滤;②_____ ;③_____ 。
(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是_____ 。
(5) 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是_____ 。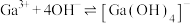 ,
,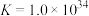 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解 ,反应
,反应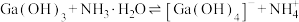 的平衡常数为
的平衡常数为_____ 。
(7)在沉铁前可以加入铁氰化钾检验 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为_____ cm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示: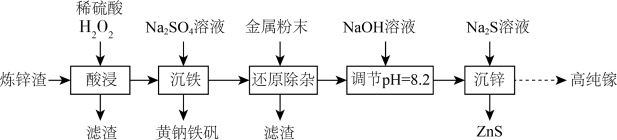
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应:
 。
。③室温时
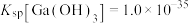 ;
;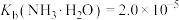 。
。④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1)
 的价层电子排布式为
的价层电子排布式为 中含有σ键的物质的量为
中含有σ键的物质的量为(2)黄钠铁矾的化学式为
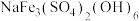 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成
 胶体,不容易过滤;②
胶体,不容易过滤;②(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是
(5)
 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是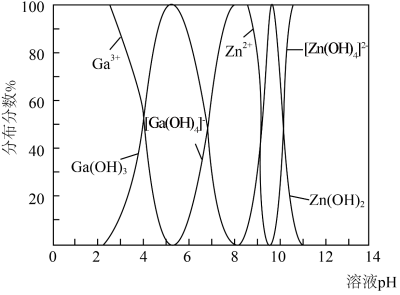
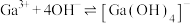 ,
,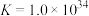 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解 ,反应
,反应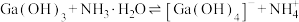 的平衡常数为
的平衡常数为(7)在沉铁前可以加入铁氰化钾检验
 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。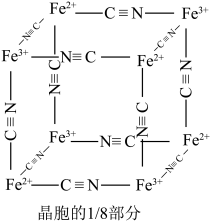
您最近一年使用:0次
7 . 高铁酸盐是一种绿色净水剂,溶于水后, 与水分子结合发生质子化,并存在平衡:
与水分子结合发生质子化,并存在平衡: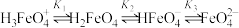 。常温下,0.1 mol⋅L
。常温下,0.1 mol⋅L 的高铁酸盐溶液中,含铁粒子的物质的量分数
的高铁酸盐溶液中,含铁粒子的物质的量分数 随pOH的变化如图所示。下列说法正确的是
随pOH的变化如图所示。下列说法正确的是
 与水分子结合发生质子化,并存在平衡:
与水分子结合发生质子化,并存在平衡: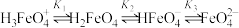 。常温下,0.1 mol⋅L
。常温下,0.1 mol⋅L 的高铁酸盐溶液中,含铁粒子的物质的量分数
的高铁酸盐溶液中,含铁粒子的物质的量分数 随pOH的变化如图所示。下列说法正确的是
随pOH的变化如图所示。下列说法正确的是
A. 时, 时,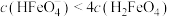 |
B.b点对应溶液的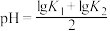 |
| C.由e点到a点溶液中水的电离程度减小 |
D.反应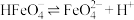 的平衡常数为 的平衡常数为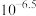 |
您最近一年使用:0次
解题方法
8 . 亚磷酸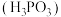 常温下电离平衡常数
常温下电离平衡常数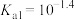 ,
, 。常温下,向
。常温下,向
 溶液中滴加
溶液中滴加 盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位
盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位 和溶液
和溶液 随盐酸体积变化曲线如下图所示。下列说法正确的是
随盐酸体积变化曲线如下图所示。下列说法正确的是
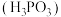 常温下电离平衡常数
常温下电离平衡常数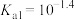 ,
, 。常温下,向
。常温下,向
 溶液中滴加
溶液中滴加 盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位
盐酸,利用电位滴定法(在化学计量点附近,指示电极电位发生突跃)得到电极电位 和溶液
和溶液 随盐酸体积变化曲线如下图所示。下列说法正确的是
随盐酸体积变化曲线如下图所示。下列说法正确的是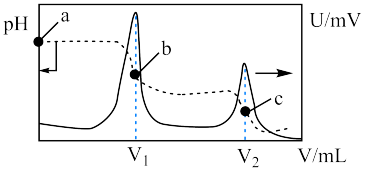
| A.滴定过程需要加入酚酞做指示剂 |
B.水的电离程度: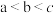 |
C. 点对应的溶液中: 点对应的溶液中: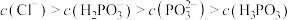 |
D. 点溶液中存在 点溶液中存在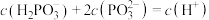 |
您最近一年使用:0次
名校
9 . 碲(Te)是元素周期表中第ⅥA元素,广泛应用于半导体材料、特殊合金等领域。从碲铜渣中(含 及少量
及少量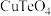 、Pb等化合物)可提取单质碲。
、Pb等化合物)可提取单质碲。
Ⅰ.干法炼碲
(1)将碲铜渣加热熔化后,向其中分批加入一定量还原碳粉,控制反应温度400~500℃,发生反应 。每消耗
。每消耗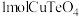 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为___________ mol。
(2)已知:常温下硫磺、单质碲的沸点分别为445℃、1390℃。将还原后的碲铜渣与稍过量硫磺混合加热,得到Cu2S、Te和硫磺混合物。将混合物置于真空炉中,控制蒸馏温度1050℃,可收集得到较纯净的Te.在真空炉中进行蒸馏的原因是___________ 。
Ⅱ.湿法提碲
(3)已知 能溶于水,
能溶于水, 难溶于水。
难溶于水。
①将一定量粉碎后的碲铜渣与NaOH、 溶液中的一种配成悬浊液,加入到三颈瓶中(装置见题图),90℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应后过滤。
溶液中的一种配成悬浊液,加入到三颈瓶中(装置见题图),90℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应后过滤。 与NaOH、
与NaOH、 反应生成
反应生成 、
、 、NaCl的离子方程式为
、NaCl的离子方程式为___________ ,滴液漏斗中的溶液是___________ 。 ,可通过还原熔炼回收Cu。为确定还原剂添加量,现通过如下实验测定滤渣中各组分的质量分数:称取0.5000g样品,分成两等份。一份加入足量稀
,可通过还原熔炼回收Cu。为确定还原剂添加量,现通过如下实验测定滤渣中各组分的质量分数:称取0.5000g样品,分成两等份。一份加入足量稀 充分反应后过滤(杂质不参加反应),用
充分反应后过滤(杂质不参加反应),用 的EDTA溶液滴定
的EDTA溶液滴定 至终点(EDTA与
至终点(EDTA与 反应的化学计量比为1:1),平均消耗EDTA溶液30.00mL;另一份加入足量稀盐酸溶解后过滤(杂质不参加反应,
反应的化学计量比为1:1),平均消耗EDTA溶液30.00mL;另一份加入足量稀盐酸溶解后过滤(杂质不参加反应,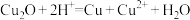 ),用相同浓度的EDTA溶液滴定
),用相同浓度的EDTA溶液滴定 至终点,平均消耗EDTA溶液20.00mL。通过计算确定滤渣中CuO的质量分数
至终点,平均消耗EDTA溶液20.00mL。通过计算确定滤渣中CuO的质量分数___________ 。(写出计算过程)
(4)已知:①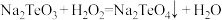 ;
;
②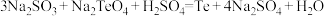 。
。
补充完整利用碱浸后含 和
和 的滤液制备高纯碲的实验方案:取碱浸后的滤液,
的滤液制备高纯碲的实验方案:取碱浸后的滤液,___________ ,将所得固体烘干。(必须使用的试剂:10% 溶液,
溶液,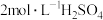 溶液,
溶液,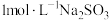 溶液,去离子水,
溶液,去离子水,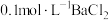 溶液)
溶液)
 及少量
及少量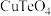 、Pb等化合物)可提取单质碲。
、Pb等化合物)可提取单质碲。Ⅰ.干法炼碲
(1)将碲铜渣加热熔化后,向其中分批加入一定量还原碳粉,控制反应温度400~500℃,发生反应
 。每消耗
。每消耗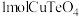 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为(2)已知:常温下硫磺、单质碲的沸点分别为445℃、1390℃。将还原后的碲铜渣与稍过量硫磺混合加热,得到Cu2S、Te和硫磺混合物。将混合物置于真空炉中,控制蒸馏温度1050℃,可收集得到较纯净的Te.在真空炉中进行蒸馏的原因是
Ⅱ.湿法提碲
(3)已知
 能溶于水,
能溶于水, 难溶于水。
难溶于水。①将一定量粉碎后的碲铜渣与NaOH、
 溶液中的一种配成悬浊液,加入到三颈瓶中(装置见题图),90℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应后过滤。
溶液中的一种配成悬浊液,加入到三颈瓶中(装置见题图),90℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应后过滤。 与NaOH、
与NaOH、 反应生成
反应生成 、
、 、NaCl的离子方程式为
、NaCl的离子方程式为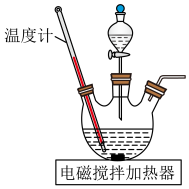
 ,可通过还原熔炼回收Cu。为确定还原剂添加量,现通过如下实验测定滤渣中各组分的质量分数:称取0.5000g样品,分成两等份。一份加入足量稀
,可通过还原熔炼回收Cu。为确定还原剂添加量,现通过如下实验测定滤渣中各组分的质量分数:称取0.5000g样品,分成两等份。一份加入足量稀 充分反应后过滤(杂质不参加反应),用
充分反应后过滤(杂质不参加反应),用 的EDTA溶液滴定
的EDTA溶液滴定 至终点(EDTA与
至终点(EDTA与 反应的化学计量比为1:1),平均消耗EDTA溶液30.00mL;另一份加入足量稀盐酸溶解后过滤(杂质不参加反应,
反应的化学计量比为1:1),平均消耗EDTA溶液30.00mL;另一份加入足量稀盐酸溶解后过滤(杂质不参加反应,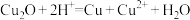 ),用相同浓度的EDTA溶液滴定
),用相同浓度的EDTA溶液滴定 至终点,平均消耗EDTA溶液20.00mL。通过计算确定滤渣中CuO的质量分数
至终点,平均消耗EDTA溶液20.00mL。通过计算确定滤渣中CuO的质量分数(4)已知:①
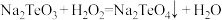 ;
;②
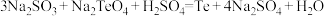 。
。补充完整利用碱浸后含
 和
和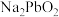 的滤液制备高纯碲的实验方案:取碱浸后的滤液,
的滤液制备高纯碲的实验方案:取碱浸后的滤液, 溶液,
溶液,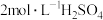 溶液,
溶液,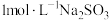 溶液,去离子水,
溶液,去离子水,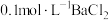 溶液)
溶液)
您最近一年使用:0次
2024-06-12更新
|
297次组卷
|
2卷引用:2024届江苏省南通市高三下学期三模化学试题
10 .  可用于“接触法”制
可用于“接触法”制 ,因
,因 在催化剂表面与
在催化剂表面与 接触得名,部分反应过程如图1。
接触得名,部分反应过程如图1。 也可以利用电化学原理来制备硫酸,如下图2(质子交换膜仅允许
也可以利用电化学原理来制备硫酸,如下图2(质子交换膜仅允许 通过)。
通过)。
 可用于“接触法”制
可用于“接触法”制 ,因
,因 在催化剂表面与
在催化剂表面与 接触得名,部分反应过程如图1。
接触得名,部分反应过程如图1。 也可以利用电化学原理来制备硫酸,如下图2(质子交换膜仅允许
也可以利用电化学原理来制备硫酸,如下图2(质子交换膜仅允许 通过)。
通过)。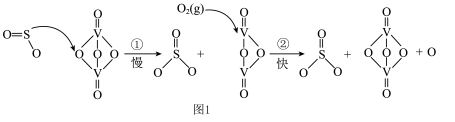
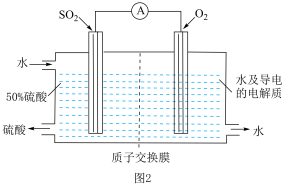
A. 和 和 都属于酸性氧化物,通入 都属于酸性氧化物,通入 溶液中都会产生白色沉淀 溶液中都会产生白色沉淀 |
B.“接触法”中增大 的浓度可明显提高 的浓度可明显提高 的生成速率和 的生成速率和 的平衡转化率 的平衡转化率 |
| C.图2中正极区溶液pH可能不变 |
D.若 的通入速率 的通入速率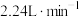 (标准状况),为维持 (标准状况),为维持 浓度不变,理论上左侧水流入速率为 浓度不变,理论上左侧水流入速率为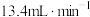 |
您最近一年使用:0次



