1 . 高分子材料在生产、生活中得到广泛应用。下列说法错误的是
| A.线型聚乙烯塑料为长链高分子,受热易软化 |
| B.聚四氟乙烯由四氟乙烯加聚合成,受热易分解 |
| C.尼龙66由己二酸和己二胺缩聚合成,强度高、韧性好 |
| D.聚甲基丙烯酸酯(有机玻璃)由甲基丙烯酸酯加聚合成,透明度高 |
您最近一年使用:0次
名校
解题方法
2 . 化学反应中的热量问题,对于化工生产有重要的意义
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=_______ kJ/mol。
(2)已知在微生物作用条件下, 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:_______ 。
(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为_______ (填“吸热”或“放热”)反应。 _______ kJ(用含a、b、c、d的代数式表示)。
(4)室温下,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示装置中进行中和反应。回答下列问题:_______ ,保持其他条件不变,实验中改用100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液进行反应,与上述实验相比,二者所测的中和热_______ (填“相等”或“不相等”),原因是_______ 。
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为_______ 。
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=_______ kJ/mol(已知该温度下水的比热容:c=4.18J/(g·℃),保留三位有效数字)。
(1)已知CO、H2、液态C2H5OH的燃烧热△H分别是-283.0 kJ/mol、-285.8 kJ/mol、-1366.8kJ/mol 。则101kPa、25℃时用冶铁炼钢废中的CO与H2合成乙醇的反应:2CO(g)+4H2(g)=C2H5OH(l)+H2O(l),该反应的△H=
(2)已知在微生物作用条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 ,两步反应的能量变化示意图如下。
,两步反应的能量变化示意图如下。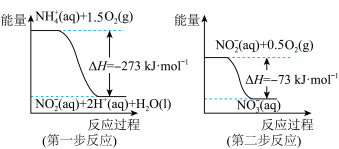
 (aq)全部被氧化成
(aq)全部被氧化成 (aq)的热化学方程式为:
(aq)的热化学方程式为:(3)由天然气和水反应制备氢气:CH4(g)+2H2O(g)=CO2(g)+4H2(g),该反应过程中能量变化如下图所示,则该反应为
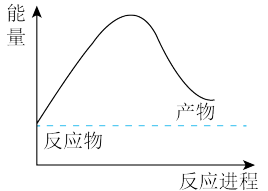
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | a | b | c | d |
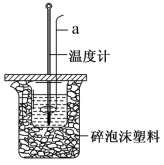
②若四次操作测得终止温度与起始温度差(T2 -T1)分别为
①3.1℃ ②5.1℃ ③3.2℃;④33℃,则所得的中和反应的中和热△H=
您最近一年使用:0次
名校
解题方法
3 . 利用电化学装置原理可以设计出许多应用于环境保护、化学品提取的装置。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。_______ 极, 电极b表面发生的电极反应为_______ 。
(2)可用电化学原理处理SO2制备硫酸并提供电能,装置如图,电极为多孔材料。写出M极的电极方程式:_______ ,外电路中电流方向为:_______ (填“从M到N”或者“从N到M”)_______ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。

(2)可用电化学原理处理SO2制备硫酸并提供电能,装置如图,电极为多孔材料。写出M极的电极方程式:
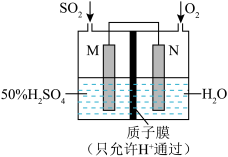

您最近一年使用:0次
名校
解题方法
4 . 一定条件下,反应H2(g)+Br2(g) 2HBr(g)的速率方程为v=kca(H2)·cb(Br2) ·cz(HBr),某温度下,该反应在不同浓度下的反应速率如下:
2HBr(g)的速率方程为v=kca(H2)·cb(Br2) ·cz(HBr),某温度下,该反应在不同浓度下的反应速率如下:
根据表中的测定结果,下列结论错误的是
 2HBr(g)的速率方程为v=kca(H2)·cb(Br2) ·cz(HBr),某温度下,该反应在不同浓度下的反应速率如下:
2HBr(g)的速率方程为v=kca(H2)·cb(Br2) ·cz(HBr),某温度下,该反应在不同浓度下的反应速率如下:| c(H2)/mol·L-l | c(Br2)/ mol·L-l | c(HBr)/ mol·L-l | 反应速率 |
| 0.1 | 0.1 | 2 | v |
| 0.1 | 0.4 | 2 | 8v |
| 0.2 | 0.4 | 2 | 16v |
| 0.4 | 0.1 | 4 | 2v |
| 0.2 | 0.1 | c | 4v |
| A.a的值为1 |
| B.表中c的值为2 |
| C.反应体系的三种物质中,Br2(g)的浓度对反应速率影响最大 |
| D.在反应体系中保持其他物质浓度不变,增大HBr(g)浓度,会使反应速率增大 |
您最近一年使用:0次
名校
解题方法
5 . 2011年中国研制的第四代隐形战机歼-20在成都首次公开试飞成功。隐形战机的核心材料是金属钛,我国探明储量世界第一、下列有关22Ti的说法不正确的是
| A.钛的原子序数为22 |
| B.钛位于元素周期表第四周期第IVB族 |
| C.基态钛原子核外电子排布式为1s22s22p63s23p63d4 |
| D.钛是d区元素 |
您最近一年使用:0次
6 . X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。
(1)写出下列元素的名称:X__________ ,Y__________ ,Z__________ 。
(2)X—H和Y—H属于极性共价键,其中极性较强的是________ (X、Y用元素符号表示)。X的第一电离能比Y的________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:_______________ 。
(4)W的基态原子的价层电子排布式为_________________ 。
(5)Y元素的核外电子轨道表达式为________________ 。
(1)写出下列元素的名称:X
(2)X—H和Y—H属于极性共价键,其中极性较强的是
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:
(4)W的基态原子的价层电子排布式为
(5)Y元素的核外电子轨道表达式为
您最近一年使用:0次
真题
解题方法
7 . 市售的溴(纯度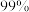 )中含有少量的
)中含有少量的 和
和 ,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓 溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为
溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为_______ ;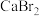 溶液的作用为
溶液的作用为_______ ;D中发生的主要反应的化学方程式为_______ 。_______ (填仪器名称)中,边加热边向其中滴加酸化的 溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成
溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成 的离子方程式为
的离子方程式为_______ 。
(3)利用图示相同装置,将R和 固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓
固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓 ,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为
,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为_______ 和_______ 。
(4)为保证溴的纯度,步骤(3)中 固体的用量按理论所需量的
固体的用量按理论所需量的 计算,若固体R质量为m克(以
计算,若固体R质量为m克(以 计),则需称取
计),则需称取_______ 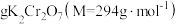 (用含m的代数式表示)。
(用含m的代数式表示)。
(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用_______ ,滤液沿烧杯壁流下。
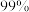 )中含有少量的
)中含有少量的 和
和 ,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓
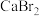 溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为
溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为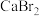 溶液的作用为
溶液的作用为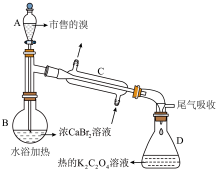
 溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成
溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成 的离子方程式为
的离子方程式为(3)利用图示相同装置,将R和
 固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓
固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓 ,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为
,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为(4)为保证溴的纯度,步骤(3)中
 固体的用量按理论所需量的
固体的用量按理论所需量的 计算,若固体R质量为m克(以
计算,若固体R质量为m克(以 计),则需称取
计),则需称取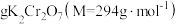 (用含m的代数式表示)。
(用含m的代数式表示)。(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用
您最近一年使用:0次
名校
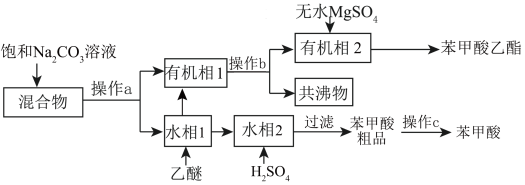
8 . 实验室初步分离苯甲酸乙酯、苯甲酸和环己烷的流程如图所示:
下列说法正确的是
下列说法正确的是
| A.操作a为分液,操作c为重结晶 |
| B.操作b需用到球形冷凝管 |
| C.可用热水洗涤苯甲酸粗品 |
D.无水 可以用浓硫酸代替 可以用浓硫酸代替 |
您最近一年使用:0次
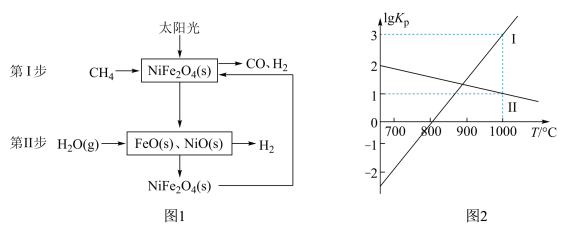
9 . 一种利用太阳能催化甲烷、水蒸气重整制氢反应原理及各步反应步骤如图1,以气体分压(单位为kPa)表示的平衡常数与温度T的变化关系如图2所示: )中铁的化合价为
)中铁的化合价为___________ 。
(2)若第Ⅰ步反应生成1mol ,吸收Q kJ热量,则第Ⅰ步反应的热化学方程式为
,吸收Q kJ热量,则第Ⅰ步反应的热化学方程式为___________ 。
(3)根据图2可知 (Ⅰ)斜率更大,受温度影响更大。则甲烷、水蒸气重整制氢反应:
(Ⅰ)斜率更大,受温度影响更大。则甲烷、水蒸气重整制氢反应: 的ΔH
的ΔH___________ 0(填“>”、“<”或“=”)。
(4)已知上述制氢过程中存在副反应: 。将
。将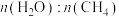
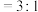 的混合气体投入温度为T的恒温恒容密闭容器中,初始压强为100kPa,若只发生甲烷、水蒸气重整反应和上述副反应,达平衡时容器内的压强为140kPa,
的混合气体投入温度为T的恒温恒容密闭容器中,初始压强为100kPa,若只发生甲烷、水蒸气重整反应和上述副反应,达平衡时容器内的压强为140kPa, 分压为10kPa,则
分压为10kPa,则 的平衡转化率为
的平衡转化率为___________ ,则甲烷、水蒸气重整反应的
___________ (列出计算式)。
(5)一定条件下,向密闭容器中加入一定量的CO、 和催化剂,发生反应:
和催化剂,发生反应: 。
。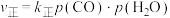 ,
,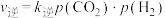 。其中
。其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 为正、逆速率常数,p为气体分压。已知降低温度时,
为正、逆速率常数,p为气体分压。已知降低温度时, 增大。调整CO和
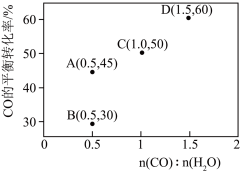
增大。调整CO和 初始投料比,测得CO的平衡转化率如下图所示,A、B、C、D四点温度由高到低的顺序是
初始投料比,测得CO的平衡转化率如下图所示,A、B、C、D四点温度由高到低的顺序是___________ ,在C点所示投料比下,当CO转化率达到40%时,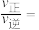
___________ 。
 )中铁的化合价为
)中铁的化合价为(2)若第Ⅰ步反应生成1mol
 ,吸收Q kJ热量,则第Ⅰ步反应的热化学方程式为
,吸收Q kJ热量,则第Ⅰ步反应的热化学方程式为(3)根据图2可知
 (Ⅰ)斜率更大,受温度影响更大。则甲烷、水蒸气重整制氢反应:
(Ⅰ)斜率更大,受温度影响更大。则甲烷、水蒸气重整制氢反应: 的ΔH
的ΔH(4)已知上述制氢过程中存在副反应:
 。将
。将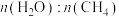
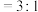 的混合气体投入温度为T的恒温恒容密闭容器中,初始压强为100kPa,若只发生甲烷、水蒸气重整反应和上述副反应,达平衡时容器内的压强为140kPa,
的混合气体投入温度为T的恒温恒容密闭容器中,初始压强为100kPa,若只发生甲烷、水蒸气重整反应和上述副反应,达平衡时容器内的压强为140kPa, 分压为10kPa,则
分压为10kPa,则 的平衡转化率为
的平衡转化率为
(5)一定条件下,向密闭容器中加入一定量的CO、
 和催化剂,发生反应:
和催化剂,发生反应: 。
。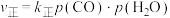 ,
,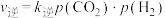 。其中
。其中 、
、 为正、逆反应速率,
为正、逆反应速率, 、
、 为正、逆速率常数,p为气体分压。已知降低温度时,
为正、逆速率常数,p为气体分压。已知降低温度时, 增大。调整CO和
增大。调整CO和 初始投料比,测得CO的平衡转化率如下图所示,A、B、C、D四点温度由高到低的顺序是
初始投料比,测得CO的平衡转化率如下图所示,A、B、C、D四点温度由高到低的顺序是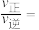
您最近一年使用:0次
名校
10 . 化合物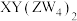 可作食品膨松剂,W、X、Y、Z为原子序数依次增大的短周期元素,W的基态原子s能级上的电子总数与p能级上的电子总数相等,W和Z同族,X的焰色为黄色,下列说法不正确的是
可作食品膨松剂,W、X、Y、Z为原子序数依次增大的短周期元素,W的基态原子s能级上的电子总数与p能级上的电子总数相等,W和Z同族,X的焰色为黄色,下列说法不正确的是
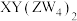 可作食品膨松剂,W、X、Y、Z为原子序数依次增大的短周期元素,W的基态原子s能级上的电子总数与p能级上的电子总数相等,W和Z同族,X的焰色为黄色,下列说法不正确的是
可作食品膨松剂,W、X、Y、Z为原子序数依次增大的短周期元素,W的基态原子s能级上的电子总数与p能级上的电子总数相等,W和Z同族,X的焰色为黄色,下列说法不正确的是| A.简单氢化物沸点:Z<W |
| B.Y的氧化物为共价化合物 |
| C.简单离子半径:Z>W>X>Y |
D.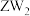 和 和 的空间结构均为V形 的空间结构均为V形 |
您最近一年使用:0次



