1 . 某研究小组用磷酸和碳酸钠制备NaH2PO4·2H2O,按如下流程开展实验。

已知:常温下NaH2PO4·2H2O为无色晶体,易溶于水,不溶于乙醇,熔点60℃,热至100℃时失去全部结晶水。磷酸易溶于乙醇。25℃,H3PO4的电离常数:Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13;H2CO3的电离常数:Ka1=4.5×10-5,Ka2=4.7×10-11。
回答下列问题:
(1)步骤Ⅱ蒸发浓缩时,将溶液转移至___________ (填仪器名称)进行加热。
(2)步骤Ⅰ用pH试纸检测溶液的pH=4.2~4.6的具体操作如下,请将操作补充完整:将广泛pH试纸置于玻璃片上,用玻璃棒蘸取溶液点在试纸中部,与标准比色卡对照、读数;___________ 。
(3)一系列操作包括:操作A、洗涤和干燥。
①写出操作A的名称___________ 。
②洗涤时,下列洗涤剂最合适的是___________ (填序号)。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液

已知:常温下NaH2PO4·2H2O为无色晶体,易溶于水,不溶于乙醇,熔点60℃,热至100℃时失去全部结晶水。磷酸易溶于乙醇。25℃,H3PO4的电离常数:Ka1=6.9×10-3,Ka2=6.2×10-8,Ka3=4.8×10-13;H2CO3的电离常数:Ka1=4.5×10-5,Ka2=4.7×10-11。
回答下列问题:
(1)步骤Ⅱ蒸发浓缩时,将溶液转移至
(2)步骤Ⅰ用pH试纸检测溶液的pH=4.2~4.6的具体操作如下,请将操作补充完整:将广泛pH试纸置于玻璃片上,用玻璃棒蘸取溶液点在试纸中部,与标准比色卡对照、读数;
(3)一系列操作包括:操作A、洗涤和干燥。
①写出操作A的名称
②洗涤时,下列洗涤剂最合适的是
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
您最近一年使用:0次
解题方法
2 . 乙二胺四乙酸(简称EDTA,结构简式为 ,白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:
,白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:

步骤1:称取94.5g氯乙酸于1000mL的仪器A中(如图1),慢慢加入50%NaHCO3溶液,至不再产生无色气泡。
步骤2:加入15.6g乙二胺,摇匀后放置片刻,加入2.0mol·L-1NaOH溶液90mL,加水至总体积为600mL左右,温度计控温50°C加热2h。
步骤3:冷却液体后倒入烧杯中,加入活性炭脱色,搅拌、静置、过滤。用盐酸调节滤液至pH=1.2,有白色沉淀生成。
步骤4:将该沉淀置于图2装置的布氏漏斗中抽滤,干燥,制得EDTA。

回答下列问题:
(1)“步骤1”中制备氯乙酸钠反应的化学方程式_______ 。
(2)制备EDTA所使用的装置(加热及夹持仪器省略)如图1所示,仪器A的名称为_______ ,仪器Q的进水口是_______ (填“a”或“b”),滴液漏斗中具支管的作用为_______ 。
(3)4ClCH2COONa+H2NCH2CH2NH2⇌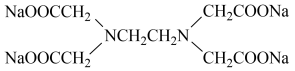 +4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为
+4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为_______ ,对A采用的加热方式_______ (选填“酒精灯”“热水浴”或“油浴”)加热。配制该NaOH溶液需要称量NaOH固体的质量为_______ g。
(4)“步骤3”中混合液的pH可用精密pH试纸测量,简述其测定溶液pH的方法_______ 。使用活性炭脱色时一般加入活性炭的量为粗产品质量的1%~5%,加入量过多造成的影响是_______ 。
(5)与普通过滤比较,“步骤4”中用图2抽滤分离EDTA的优点是_______ 。
 ,白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:
,白色粉末,微溶于冷水)是一种能与Ca2+、Mg2+等结合的螯合剂,可用其测定地下水的硬度。某实验室用氯乙酸(ClCH2COOH)、乙二胺(H2NCH2CH2NH2)、NaOH为原料制备EDTA步骤如下:
步骤1:称取94.5g氯乙酸于1000mL的仪器A中(如图1),慢慢加入50%NaHCO3溶液,至不再产生无色气泡。
步骤2:加入15.6g乙二胺,摇匀后放置片刻,加入2.0mol·L-1NaOH溶液90mL,加水至总体积为600mL左右,温度计控温50°C加热2h。
步骤3:冷却液体后倒入烧杯中,加入活性炭脱色,搅拌、静置、过滤。用盐酸调节滤液至pH=1.2,有白色沉淀生成。
步骤4:将该沉淀置于图2装置的布氏漏斗中抽滤,干燥,制得EDTA。

回答下列问题:
(1)“步骤1”中制备氯乙酸钠反应的化学方程式
(2)制备EDTA所使用的装置(加热及夹持仪器省略)如图1所示,仪器A的名称为
(3)4ClCH2COONa+H2NCH2CH2NH2⇌
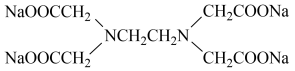 +4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为
+4HCl是“步骤2”中的发生反应,该步骤中使用NaOH的作用为(4)“步骤3”中混合液的pH可用精密pH试纸测量,简述其测定溶液pH的方法
(5)与普通过滤比较,“步骤4”中用图2抽滤分离EDTA的优点是
您最近一年使用:0次
名校
解题方法
3 . 有一瓶无色透明溶液,其中可能含有Na+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、I-。取该溶液进行以下实验:
①用pH试纸测得该溶液显酸性;
②取部分溶液,加入数滴新制氯水及少量CCl4,经振荡、静置后,CCl4层呈紫红色;
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变至碱性,在整个滴加过程中无沉淀生成;
④取部分③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成;
(1)该溶液为无色透明溶液,可确定其中一定不含___________ ;(填离子符号,下同)
(2)由步骤①中测量溶液pH的方法_____________________________________________ ,通过测量结果可知,溶液中一定不存在____________ ;
(3)由步骤②可知,溶液中含有____________ ;
(4)由步骤③可排除_____________ 、____________ 的存在;
(5)由步骤④可知,溶液中含有_________ ,由此可排除_________ 的存在;
(6)通过实验不能确定___________ 是否存在。
①用pH试纸测得该溶液显酸性;
②取部分溶液,加入数滴新制氯水及少量CCl4,经振荡、静置后,CCl4层呈紫红色;
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变至碱性,在整个滴加过程中无沉淀生成;
④取部分③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成;
(1)该溶液为无色透明溶液,可确定其中一定不含
(2)由步骤①中测量溶液pH的方法
(3)由步骤②可知,溶液中含有
(4)由步骤③可排除
(5)由步骤④可知,溶液中含有
(6)通过实验不能确定
您最近一年使用:0次



