解题方法
1 . 请回答下列问题:
(1)下列有关实验操作或结果的说法中正确的是___________ (填字母)。
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.滴定实验都需要指示剂
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为___________ ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是___________ 。
(3)NaHSO3溶液显酸性的原因是___________ (用化学用语和必要的文字说明)。
(4)常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为___________ 。
(1)下列有关实验操作或结果的说法中正确的是
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.滴定实验都需要指示剂
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为
(3)NaHSO3溶液显酸性的原因是
(4)常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为
您最近一年使用:0次
2022-01-08更新
|
89次组卷
|
2卷引用:湖北省十堰市2016-2017学年高二上学期期末调研考试化学试题
解题方法
2 . 已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
Ⅰ、(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。将该溶液加水稀释至1 000 mL,所得溶液pH数值范围为_______ ;若加入少量NaOH溶液,则溶液中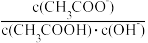
_______ (填“增大”“减小”“不变”或“不能确定”)。
(2)25 ℃时,0.1 mol·L-1的氨水的pH=_______ 。
(3)用pH试纸测定该氨水pH的操作方法为_______ 。
(4)pH相等的氨水和Na2CO3溶液中,水电离出的OH-浓度分别为a mol/L和b mol/L。则a_______ b(填“>”、“<”或“=”)。
Ⅱ、现用醋酸标准溶液来测定NaOH溶液的浓度。含以下实验操作:
①向溶液中加入1~2滴指示剂②取20.00 mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点④重复以上操作
⑤配制250 mL醋酸标准溶液⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是_______ (填序号),该滴定实验所选指示剂为_______ 。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积V(NaOH)=  mL=20.20 mL。他的计算
mL=20.20 mL。他的计算_______ (填“合理”或“不合理”),理由是_______ 。通过仪器测得第4次滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图所示,则a_______ 20.02(填“>”、“<”或“=”)。

Ⅰ、(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。将该溶液加水稀释至1 000 mL,所得溶液pH数值范围为
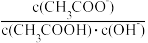
(2)25 ℃时,0.1 mol·L-1的氨水的pH=
(3)用pH试纸测定该氨水pH的操作方法为
(4)pH相等的氨水和Na2CO3溶液中,水电离出的OH-浓度分别为a mol/L和b mol/L。则a
Ⅱ、现用醋酸标准溶液来测定NaOH溶液的浓度。含以下实验操作:
①向溶液中加入1~2滴指示剂②取20.00 mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点④重复以上操作
⑤配制250 mL醋酸标准溶液⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(CH3COOH)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
 mL=20.20 mL。他的计算
mL=20.20 mL。他的计算
您最近一年使用:0次
解题方法
3 . (1)室温下,使用pH计测定0.1 mol/L NH4Cl溶液的pH(如图1),由此可以得到的结论是_____ (填字母)。
a.NH3·H2O是弱碱 b.溶液中c(H+)>c(OH-)
c.NH4+水解是吸热反应 d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7


(2)室温下,用0.10 mol/LNaOH溶液分别滴定20.00 mL0.10 mol/L的盐酸和醋酸,滴定曲线如图2所示。
①表示滴定盐酸的曲线是_______ (填序号)。若此实验选用酚酞为指示剂,则滴定到达终点的现象是______ 。若用标准NaOH溶液测定未知盐酸溶液的浓度,下列实验操作会使实验结果偏低的是________ 。
a.锥形瓶用待测液润洗后再注入待测液
b.碱式滴定管滴定前有气泡,滴定后无气泡
c.碱式滴定管滴定前仰视读数,滴定后平视读数
d.碱式滴定管未用标准液润洗
②测定过程中使用到移液管,选出其正确操作并按序列出字母:蒸馏水洗涤→待转移溶液润洗→_______ →_______ →_______ →_______ →洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
a.NH3·H2O是弱碱 b.溶液中c(H+)>c(OH-)
c.NH4+水解是吸热反应 d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7


(2)室温下,用0.10 mol/LNaOH溶液分别滴定20.00 mL0.10 mol/L的盐酸和醋酸,滴定曲线如图2所示。
①表示滴定盐酸的曲线是
a.锥形瓶用待测液润洗后再注入待测液
b.碱式滴定管滴定前有气泡,滴定后无气泡
c.碱式滴定管滴定前仰视读数,滴定后平视读数
d.碱式滴定管未用标准液润洗
②测定过程中使用到移液管,选出其正确操作并按序列出字母:蒸馏水洗涤→待转移溶液润洗→
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
您最近一年使用:0次
名校
4 . 甲、乙两同学拟用试验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_________ 。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH___________ 1(选填“>”、“<”或“=”)。简要说明pH试纸的使用方法:_________________ 。
(3)乙方案中,说明HA是弱电解质的现象是_____________ 。
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH
(3)乙方案中,说明HA是弱电解质的现象是
您最近一年使用:0次
2017-02-17更新
|
222次组卷
|
2卷引用:甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题
5 . 已知:(A)Cu2+,Fe2+在pH为4~5的条件下不水解而Fe3+却几乎全部水解;(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50mL的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,溶液的pH是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH为4,过滤。
④把③所得滤液浓缩。
(1)②中发生反应的离子方程式是_________________________________________ 。
(2)③中过滤后滤渣的成分是_______________ 。
(3)①③中如何用pH试纸测定溶液的pH值:_________________________________ 。
(4)③中pH升高的原因是:____________________________ 。(用离子方程式表示)
①取50mL的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,溶液的pH是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH为4,过滤。
④把③所得滤液浓缩。
(1)②中发生反应的离子方程式是
(2)③中过滤后滤渣的成分是
(3)①③中如何用pH试纸测定溶液的pH值:
(4)③中pH升高的原因是:
您最近一年使用:0次
12-13高二上·山东临沂·期末
6 . 甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是________________ 。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH____ 1(选填“>”、“<”或“=”)。简要说明pH试纸的使用方法:_________________________________________________________ 。
(3)乙方案中,说明HA是弱电解质的现象是_______________________________________________________________________ 。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),并作简明扼要表述:_______________________ 。
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH
(3)乙方案中,说明HA是弱电解质的现象是
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),并作简明扼要表述:
您最近一年使用:0次
2016-12-09更新
|
564次组卷
|
4卷引用:2011-2012学年山东省临沂市高二上学期期末模块质量调研化学试卷
(已下线)2011-2012学年山东省临沂市高二上学期期末模块质量调研化学试卷(已下线)2012-2013学年山东省临沂市重点高中高二上学期期末考试化学试卷山西省大同市天镇县第一中学校2019-2020学年高二上学期第二次月考化学试题内蒙古呼和浩特市第十六中学2020-2021学年高二上学期第一次质量检测化学试题
11-12高二上·黑龙江牡丹江·期末
7 . 一学生在实验室测某溶液pH。实验时他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
①这种错误操作是否导致实验结果一定有误差?答:___________ 。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是___________ ,原因是___________ ;另一同学用正确的方法测定NH4Cl溶液的pH﹤7,用离子方程式表示原因:___________ 。
①这种错误操作是否导致实验结果一定有误差?答:
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是
您最近一年使用:0次
11-12高二上·广东梅州·期末
解题方法
8 . (1)下列有关实验操作或结果的说法中错误的是_________________
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:__________________________________________
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:_____________________________________________________________
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)________________ 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),________________ 和________________ 两种粒子的物质的量之和比OH―多0.05mol。
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
您最近一年使用:0次
9-10高二下·江苏连云港·期末
9 . (1)下列有关实验操作或结果的说法中正确的是_________________
A.将pH试纸用蒸馏水湿润后,测量某溶液的pH
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
F.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
(2)某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验加以验证。
①猜想:这种试剂可能是_____________________ ;
②简述验证的实验方案:____________________________ 。
A.将pH试纸用蒸馏水湿润后,测量某溶液的pH
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
F.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
(2)某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验加以验证。

①猜想:这种试剂可能是
②简述验证的实验方案:
您最近一年使用:0次
9-10高二下·浙江台州·期末
解题方法
10 . 某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
(1)Ⅰ:甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。

则X溶液是______ 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。

①写出测定溶液pH值的操作方法:______ ;
②上图中哪个图像符合该同学的记录______ (填序号)。
(3)你认为甲、乙两位同学的实验中,______ (填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:______ 。
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
(4)根据以上数据计算出盐酸的物质的量浓度为______ mol·L-1。
(5)如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。______ 。
(1)Ⅰ:甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。

则X溶液是
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。

①写出测定溶液pH值的操作方法:
②上图中哪个图像符合该同学的记录
(3)你认为甲、乙两位同学的实验中,
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
| 滴定次数 | 盐酸的体积/mL | NaOH溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
(5)如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。
您最近一年使用:0次



