甲、乙两同学拟用试验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_________ 。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH___________ 1(选填“>”、“<”或“=”)。简要说明pH试纸的使用方法:_________________ 。
(3)乙方案中,说明HA是弱电解质的现象是_____________ 。
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH
(3)乙方案中,说明HA是弱电解质的现象是
更新时间:2017-02-17 14:56:24
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】(1)下列有关实验操作或结果的说法中正确的是_________________
A.将pH试纸用蒸馏水湿润后,测量某溶液的pH
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
F.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
(2)某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验加以验证。
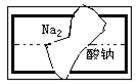
①猜想:这种试剂可能是_____________________ ;
②简述验证的实验方案:____________________________ 。
A.将pH试纸用蒸馏水湿润后,测量某溶液的pH
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
F.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
(2)某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验加以验证。

①猜想:这种试剂可能是
②简述验证的实验方案:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:
已知:①Cr2O72-+H2O 2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)碱溶的目的是__________ ,所加40%NaOH不宜过量太多的原因是______________________ 。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_____________ 。
(3)使用下列用品来测定溶液的pH,合理的是_____ (填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。
①图中仪器A的名称为_______ 。
②在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:___________ 。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体_____ ,____ ,冷却结晶,过滤,____ ,低温干燥,得到CrCl3·6H2O。(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)

已知:①Cr2O72-+H2O
 2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
2CrO42-+2H+;②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。(1)碱溶的目的是
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式
(3)使用下列用品来测定溶液的pH,合理的是
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。
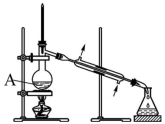
①图中仪器A的名称为
②在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。请回答相关问题:
(1)已知双氧水(H2O2)和水都是极弱的电解质,但H2O2 比H2O更显酸性。若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:_______ 。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:_______ 。
(3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式:_______ 。
(4)实验测得常温下质量分数为0.51% H2O2水溶液(密度为1g/mL)的pH为5.测定H2O2水溶液pH的方法为(填编号)_______。
(5)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:MnO +H2O2+H+— Mn2++H2O+O2↑(未配平)
+H2O2+H+— Mn2++H2O+O2↑(未配平)
①滴定达到终点的标志是_______ 。
②用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000 mol·L-1的KMnO4标准溶液体积如下表所示:
计算试样中过氧化氢的浓度为_______ mol·L-1。
③若实验结束时俯视刻度线读取滴定终点,则测定结果_______ (“偏高”或“偏低”或“不变”,下同),若滴定前尖嘴中有气泡滴定后消失,则测定结果_______ 。
(1)已知双氧水(H2O2)和水都是极弱的电解质,但H2O2 比H2O更显酸性。若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:
(3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式:
(4)实验测得常温下质量分数为0.51% H2O2水溶液(密度为1g/mL)的pH为5.测定H2O2水溶液pH的方法为(填编号)_______。
| A.用酸碱指示剂测定 | B.用广泛pH试纸测定 |
| C.用精密pH试纸测定 | D.用pH计测定 |
 +H2O2+H+— Mn2++H2O+O2↑(未配平)
+H2O2+H+— Mn2++H2O+O2↑(未配平)①滴定达到终点的标志是
②用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000 mol·L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
③若实验结束时俯视刻度线读取滴定终点,则测定结果
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】已知 是常见的弱酸,现有常温下
是常见的弱酸,现有常温下 的
的 溶液。
溶液。
(1)取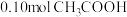 作导电性实验,测得其导电率随加入的水量变化如图所示。
作导电性实验,测得其导电率随加入的水量变化如图所示。

① :a
:a___________ b(填“>”、“<”或“=”,下同);
② :a
:a___________ b;
③完全中和时消耗NaOH的物质的量:a___________ b。
(2)温度不变,加水稀释过程中,下列表达式的数据一定变小的是___________(填字母,下同);若该溶液升高温度,下列表达式的数据增大的是___________。
(3)25℃时,部分物质的电离平衡常数如下表所示:
① 、
、 、HCN的酸性由强到弱的顺序为
、HCN的酸性由强到弱的顺序为___________ 。
②焦炉煤气中一般含有 和HCN气体,有的工厂在真空条件下,使用
和HCN气体,有的工厂在真空条件下,使用 溶液吸收煤气中的
溶液吸收煤气中的 和HCN气体,实现脱硫脱氰。根据上述数据,从理论上推测同为
和HCN气体,实现脱硫脱氰。根据上述数据,从理论上推测同为 的
的 溶液和HCN混合后,最可能发生反应的离子方程式为
溶液和HCN混合后,最可能发生反应的离子方程式为___________ 。
 是常见的弱酸,现有常温下
是常见的弱酸,现有常温下 的
的 溶液。
溶液。(1)取
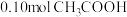 作导电性实验,测得其导电率随加入的水量变化如图所示。
作导电性实验,测得其导电率随加入的水量变化如图所示。
①
 :a
:a②
 :a
:a③完全中和时消耗NaOH的物质的量:a
(2)温度不变,加水稀释过程中,下列表达式的数据一定变小的是___________(填字母,下同);若该溶液升高温度,下列表达式的数据增大的是___________。
A. | B.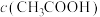 |
C. | D.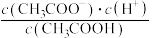 |
 |  | HCN |
 |  、 、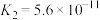 |  |
 、
、 、HCN的酸性由强到弱的顺序为
、HCN的酸性由强到弱的顺序为②焦炉煤气中一般含有
 和HCN气体,有的工厂在真空条件下,使用
和HCN气体,有的工厂在真空条件下,使用 溶液吸收煤气中的
溶液吸收煤气中的 和HCN气体,实现脱硫脱氰。根据上述数据,从理论上推测同为
和HCN气体,实现脱硫脱氰。根据上述数据,从理论上推测同为 的
的 溶液和HCN混合后,最可能发生反应的离子方程式为
溶液和HCN混合后,最可能发生反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】现有室温下浓度均为1×10-3mol·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氨水、⑤NaOH溶液。回答下列问题:
(1)上述5种溶液中,水电离出的c(H+)最小的是_______ 。(填序号,下同)
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为________________ ,最终产生H2总量的关系为________ 。
(3)若将等体积的④、⑤溶液加热至相同温度后,溶液的pH大小关系为④________ ⑤。(填“>”、“<”、“=”)
(4)在25℃时,某Na2SO4溶液中c( )=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=
)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=___________ 。
(5)t℃时,水的离子积为1×10-12,将pH=11的NaOH溶液V1L与pH=1的稀硫酸V2L混合(假设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1:V2=________ 。
(6)泡沫灭火器中装有硫酸铝和碳酸氢钠溶液,二者混合时发生剧烈反应,请写出灭火时发生反应的离子方程式___________ 。利用纯碱溶液的碱性可以去除油污,呈碱性的原因是(填离子方程式)______
(1)上述5种溶液中,水电离出的c(H+)最小的是
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为
(3)若将等体积的④、⑤溶液加热至相同温度后,溶液的pH大小关系为④
(4)在25℃时,某Na2SO4溶液中c(
 )=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=
)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=(5)t℃时,水的离子积为1×10-12,将pH=11的NaOH溶液V1L与pH=1的稀硫酸V2L混合(假设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1:V2=
(6)泡沫灭火器中装有硫酸铝和碳酸氢钠溶液,二者混合时发生剧烈反应,请写出灭火时发生反应的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】25℃时,三种弱酸的电离平衡常数如表所示。
(1)将 pH 和体积均相同的 CH3COOH 溶液和 HNO2溶液分别稀释,其 pH 随加水体积的变化如图所示。
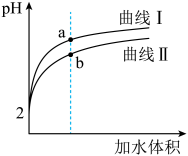
① 曲线Ⅰ代表______ 溶液(填“HNO2”或“CH3COOH”)。
② 图中,水的电离程度较小的是______ (填“a”或“b”)。
③ 若向上述CH3COOH 和HNO2 溶液中分别滴加等浓度的NaOH 溶液,恰好中和时消耗NaOH 溶液体积分别为V1 和 V2。则 V1______ V2(填“>”、“<”或“=”)。
(2)① H2C2O4的电离方程式为______ 。
② 25℃时,0.1 mol·L-1 NaHC2O4 溶液显______ 性(填“酸”、“碱”或“中”)。
(3)工业上脱硝常用 6%的稀硝酸吸收 NOx 生成 HNO2,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。

① 图中 b 应连接电源的______ 极(填“正”或“负”)。
② 阳极的电极反应式为______ 。
| 名称 | 醋酸 | 亚硝酸 | 草酸 |
| 化学式 | CH3COOH | HNO2 | H2C2O4 |
| 电离平衡常数 | 1.8×10-5 | 5.0×10-4 | Ka1=5.9×10-2 Ka2=6.5×10-5 |
(1)将 pH 和体积均相同的 CH3COOH 溶液和 HNO2溶液分别稀释,其 pH 随加水体积的变化如图所示。

① 曲线Ⅰ代表
② 图中,水的电离程度较小的是
③ 若向上述CH3COOH 和HNO2 溶液中分别滴加等浓度的NaOH 溶液,恰好中和时消耗NaOH 溶液体积分别为V1 和 V2。则 V1
(2)① H2C2O4的电离方程式为
② 25℃时,0.1 mol·L-1 NaHC2O4 溶液显
(3)工业上脱硝常用 6%的稀硝酸吸收 NOx 生成 HNO2,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。

① 图中 b 应连接电源的
② 阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I、300℃时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)⇌2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
(1)反应0~2minZ的平均速率v(Z)=____
(2)能判断该反应已经达到平衡状态的是____
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)温度为300℃时,该反应的化学平衡常数K=___
II、(1)常温下,0.005mol·L-1Ba(OH)2溶液的pH=_____
(2)常温下,向0.1mol·L-1NH3·H2O溶液中不断加水,过程中c(OH-)/c(NH3·H2O)将____ (选填“增大”、“减小”或“不变”)
(3)下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
某溶液中含Fe3+、Al3+、Zn2+,欲除去Fe3+、Al3+,向其中滴加1.0moL·L-1的NaOH溶液调节溶液的pH为___ 。
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)反应0~2minZ的平均速率v(Z)=
(2)能判断该反应已经达到平衡状态的是
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)温度为300℃时,该反应的化学平衡常数K=
II、(1)常温下,0.005mol·L-1Ba(OH)2溶液的pH=
(2)常温下,向0.1mol·L-1NH3·H2O溶液中不断加水,过程中c(OH-)/c(NH3·H2O)将
(3)下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
| Fe3+ | Al3+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 3.2 | 5.9 |
| 完全沉淀的pH | 3.2 | 5 | 8.9 |
某溶液中含Fe3+、Al3+、Zn2+,欲除去Fe3+、Al3+,向其中滴加1.0moL·L-1的NaOH溶液调节溶液的pH为
您最近一年使用:0次
【推荐2】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应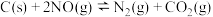 △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
△H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①据图表数据分析T1℃时,该反应在0~10 min内的平均反应速率v(N2)=________ mol/(L·min);计算该反应的平衡常数K=________ 。
②若30 min后只改变某一条件,据上表中的数据判断改变的条件可能是________ (填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率________ (填“升高”或“降低”),△H________ 0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:

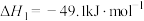

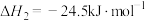
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式________ 。
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c( ):c(
):c( )=
)=________ 。[常温下 、
、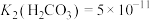 ]。
]。
②欲用2 L Na2CO3溶液将4.66 g BaSO4(233 g/mol)固体全部都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为________ 。[已知:常温下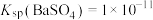 ,
,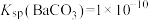 ]。(忽略溶液体积的变化)
]。(忽略溶液体积的变化)
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应
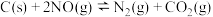 △H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:
△H,在T1℃时,反应进行到不同时间测得各物质的浓度如下:| 浓度/(mol/L) 时间/min | 0 | 10 | 20 | 30 | 40 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
| N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
②若30 min后只改变某一条件,据上表中的数据判断改变的条件可能是
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率
(2)工业上用CO2和H2反应合成二甲醚。已知:

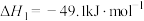

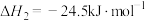
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(
 ):c(
):c( )=
)= 、
、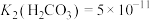 ]。
]。②欲用2 L Na2CO3溶液将4.66 g BaSO4(233 g/mol)固体全部都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
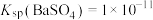 ,
,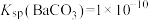 ]。(忽略溶液体积的变化)
]。(忽略溶液体积的变化)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】硒是人体所需微量元素之一,也是一种重要的工业原料。
Ⅰ.硒在元素周期表中的位置如图所示:
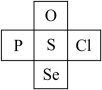
(1)从原子结构的角度解释硫的非金属性比硒强的原因是__ 。
Ⅱ.工业上从铜阳极泥(含有Se、Au、Ag、Cu、CuSe、Ag2Se等)中提取硒的过程如图:
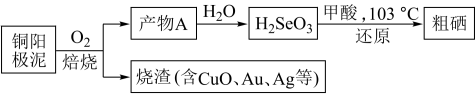
(2)焙烧时,产物A的化学式为__ 。
(3)将甲酸(HCOOH)还原H2SeO3反应的化学方程式补充完整:H2SeO3+2HCOOH Se+
Se+ +
+ 。
。______ 。
(4)常温下,H2SeO3电离平衡体系中含Se(+4价)微粒的物质的量分数与pH的关系如图所示。
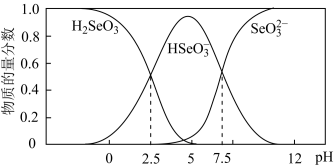
向亚硒酸溶液滴入氨水至pH=2.5,过程中主要反应的离子方程式__ 。
(5)还原时,进行了下述实验:向10mL2.5mol·L-1亚硒酸溶液中先加入10mL氨水,再加入10mL甲酸溶液(甲酸浓度分别为5、7.5及10mol·L-1),加热至沸腾(103℃),反应10小时,实验数据如图所示。
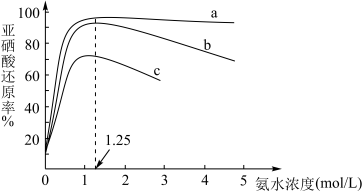
①曲线___ (填曲线字母编号)对应甲酸浓度为10mol·L-1,判断的理由是___ 。
②当氨水浓度在0~1.25mol·L-1之间,随着氨水浓度逐渐增大,亚硒酸还原率逐渐升高,其可能的原因是__ 。
(6)粗硒中硒含量测定:
在一定条件下,将0.1000g粗硒中的Se完全转化为H2SeO3溶液,用V1mL0.1000mol·L-1Na2S2O3溶液进行滴定。终点前加入KI淀粉溶液做指示剂,继续用V2mL0.1000mol·L-1Na2S2O3溶液滴定至溶液蓝色消失。发生的反应:
H2SeO3+4S2O +4H+=Se+2S4O
+4H+=Se+2S4O +3H2O
+3H2O ;
;
H2SeO3+4I-+4H+=Se+2I2+3H2O;
I2+2S2O =2I-+S4O
=2I-+S4O 。则粗硒中Se的质量分数为
。则粗硒中Se的质量分数为___ 。
Ⅰ.硒在元素周期表中的位置如图所示:

(1)从原子结构的角度解释硫的非金属性比硒强的原因是
Ⅱ.工业上从铜阳极泥(含有Se、Au、Ag、Cu、CuSe、Ag2Se等)中提取硒的过程如图:

(2)焙烧时,产物A的化学式为
(3)将甲酸(HCOOH)还原H2SeO3反应的化学方程式补充完整:H2SeO3+2HCOOH
 Se+
Se+ +
+ 。
。(4)常温下,H2SeO3电离平衡体系中含Se(+4价)微粒的物质的量分数与pH的关系如图所示。

向亚硒酸溶液滴入氨水至pH=2.5,过程中主要反应的离子方程式
(5)还原时,进行了下述实验:向10mL2.5mol·L-1亚硒酸溶液中先加入10mL氨水,再加入10mL甲酸溶液(甲酸浓度分别为5、7.5及10mol·L-1),加热至沸腾(103℃),反应10小时,实验数据如图所示。

①曲线
②当氨水浓度在0~1.25mol·L-1之间,随着氨水浓度逐渐增大,亚硒酸还原率逐渐升高,其可能的原因是
(6)粗硒中硒含量测定:
在一定条件下,将0.1000g粗硒中的Se完全转化为H2SeO3溶液,用V1mL0.1000mol·L-1Na2S2O3溶液进行滴定。终点前加入KI淀粉溶液做指示剂,继续用V2mL0.1000mol·L-1Na2S2O3溶液滴定至溶液蓝色消失。发生的反应:
H2SeO3+4S2O
 +4H+=Se+2S4O
+4H+=Se+2S4O +3H2O
+3H2O ;
;H2SeO3+4I-+4H+=Se+2I2+3H2O;
I2+2S2O
 =2I-+S4O
=2I-+S4O 。则粗硒中Se的质量分数为
。则粗硒中Se的质量分数为
您最近一年使用:0次



