名校
解题方法
1 . 高铁酸盐是优良的多功能水处理剂。
 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在
溶液,难溶于有机物;在 、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。
。
某实验小组以次氯酸盐和铁盐为原料制备少量高铁酸钾 并测定产品纯度。
并测定产品纯度。
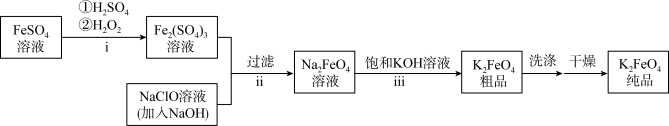
(一)根据上图回答下列问题:
(1)i中反应的离子方程式是___________ ;
(2)检验 溶液中是否含有
溶液中是否含有 的离子方程式
的离子方程式___________ ;
(3)将ii中反应的离子方程式补充完整:_______
___________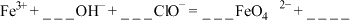 +___________
+___________
(4)iii中反应说明溶解度:
___________  (填“>”或“<”);
(填“>”或“<”);
(5)反应iii中 必须过量的原因是
必须过量的原因是___________ 。
(二)制备 强碱性饱和溶液:
强碱性饱和溶液:
①将 溶液加入仪器b中,冷水浴冷却,通入
溶液加入仪器b中,冷水浴冷却,通入 搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。
搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。

②将所得饱和 倒入烧杯并置于冷水浴中,分几次加入
倒入烧杯并置于冷水浴中,分几次加入 固体并不断傥拌,过滤,得
固体并不断傥拌,过滤,得 强碱性饱和溶液。
强碱性饱和溶液。
(6)仪器a的名称为___________ ,该仪器的作用是___________ ;仪器b的名称为___________ 。
(7)写出甲装置中反应的离子方程式___________ 。
(8)石灰乳的作用是___________ 。
(9)反应过程中用冷水浴冷却的原因是___________ 。
(三)合成
①将 溶液,在冷水浴中分批加入(二)中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即
溶液,在冷水浴中分批加入(二)中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即 )。
)。
②离心分离除去 水解得到的
水解得到的 胶体,留上层清液(深紫红色)。
胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入 饱和溶液
饱和溶液 ,冰水浴保持
,冰水浴保持 ,过滤,得
,过滤,得 (相对分子质量为198)粗产品。
(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品。
(10)用异丙醇洗涤的目的是___________ 。
(四) 产品纯度的测定
产品纯度的测定
准确称取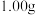 制得的晶体,配成
制得的晶体,配成 溶液,准确量取
溶液,准确量取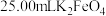 溶液放入锥形瓶,
溶液放入锥形瓶,
①加入足量 和
和 溶液,振荡,再加入稀硫酸酸化后得
溶液,振荡,再加入稀硫酸酸化后得 和
和 ,
,
②滴入几滴二苯胺磺酸钠作指示剂,用 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液
标准溶液 。
。
(11)加入 标准溶液后反应的离子方程式为
标准溶液后反应的离子方程式为___________ ;
(12)用根据以上数据,样品中 的质量分数为
的质量分数为___________ 。
(13)若 标准溶液部分变质,会使测定结果
标准溶液部分变质,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在
溶液,难溶于有机物;在 、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。
。某实验小组以次氯酸盐和铁盐为原料制备少量高铁酸钾
 并测定产品纯度。
并测定产品纯度。
(一)根据上图回答下列问题:
(1)i中反应的离子方程式是
(2)检验
 溶液中是否含有
溶液中是否含有 的离子方程式
的离子方程式(3)将ii中反应的离子方程式补充完整:
___________
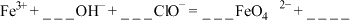 +___________
+___________(4)iii中反应说明溶解度:

 (填“>”或“<”);
(填“>”或“<”);(5)反应iii中
 必须过量的原因是
必须过量的原因是(二)制备
 强碱性饱和溶液:
强碱性饱和溶液:①将
 溶液加入仪器b中,冷水浴冷却,通入
溶液加入仪器b中,冷水浴冷却,通入 搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。
搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。
②将所得饱和
 倒入烧杯并置于冷水浴中,分几次加入
倒入烧杯并置于冷水浴中,分几次加入 固体并不断傥拌,过滤,得
固体并不断傥拌,过滤,得 强碱性饱和溶液。
强碱性饱和溶液。(6)仪器a的名称为
(7)写出甲装置中反应的离子方程式
(8)石灰乳的作用是
(9)反应过程中用冷水浴冷却的原因是
(三)合成

①将
 溶液,在冷水浴中分批加入(二)中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即
溶液,在冷水浴中分批加入(二)中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即 )。
)。②离心分离除去
 水解得到的
水解得到的 胶体,留上层清液(深紫红色)。
胶体,留上层清液(深紫红色)。③向②的上层清液中缓慢加入
 饱和溶液
饱和溶液 ,冰水浴保持
,冰水浴保持 ,过滤,得
,过滤,得 (相对分子质量为198)粗产品。
(相对分子质量为198)粗产品。④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品。
(10)用异丙醇洗涤的目的是
(四)
 产品纯度的测定
产品纯度的测定准确称取
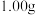 制得的晶体,配成
制得的晶体,配成 溶液,准确量取
溶液,准确量取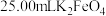 溶液放入锥形瓶,
溶液放入锥形瓶,①加入足量
 和
和 溶液,振荡,再加入稀硫酸酸化后得
溶液,振荡,再加入稀硫酸酸化后得 和
和 ,
,②滴入几滴二苯胺磺酸钠作指示剂,用
 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液
标准溶液 。
。(11)加入
 标准溶液后反应的离子方程式为
标准溶液后反应的离子方程式为(12)用根据以上数据,样品中
 的质量分数为
的质量分数为(13)若
 标准溶液部分变质,会使测定结果
标准溶液部分变质,会使测定结果
您最近一年使用:0次
2 . 水合肼可用于生产火箭燃料,以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
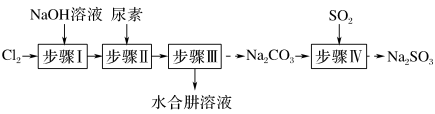
已知:①Cl2+2OH−=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O 沸点约 118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)实验步骤Ⅰ需要控制反应的温度,避免温度过高,可以采取的措施有___________ 。若温度过高,Cl2与NaOH溶液反应生成NaClO3和NaCl,其化学方程式为___________ 。
(2)步骤Ⅱ合成N2H4·H2O的装置如图所示。NaClO 碱性溶液与尿素水溶液在40℃以下反应,一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加NaClO溶液,发生的离子方程式为___________ 。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,为测定制得的Na2SO3的纯度,准确称取样品1.260 g加水稀释至250 mL,取25.00 mL于锥形瓶中,用0.020 mol·L-1的KMnO4标准溶液滴定,消耗KMnO4标准溶液16.00 mL:
①滴定达到终点的现象为___________ ;
②该样品的纯度为___________ ;
③误差分析:下列操作会使测定结果偏低的是___________ 。
A.滴定终点读数时俯视滴定管刻度线
B.锥形瓶用蒸馏水洗后没有干燥
C.实验前装标准溶液的滴定管没有润洗
D.滴定后滴定管尖端有气泡

已知:①Cl2+2OH−=ClO-+Cl-+H2O是放热反应。
②N2H4·H2O 沸点约 118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)实验步骤Ⅰ需要控制反应的温度,避免温度过高,可以采取的措施有
(2)步骤Ⅱ合成N2H4·H2O的装置如图所示。NaClO 碱性溶液与尿素水溶液在40℃以下反应,一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加NaClO溶液,发生的离子方程式为

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,为测定制得的Na2SO3的纯度,准确称取样品1.260 g加水稀释至250 mL,取25.00 mL于锥形瓶中,用0.020 mol·L-1的KMnO4标准溶液滴定,消耗KMnO4标准溶液16.00 mL:
①滴定达到终点的现象为
②该样品的纯度为
③误差分析:下列操作会使测定结果偏低的是
A.滴定终点读数时俯视滴定管刻度线
B.锥形瓶用蒸馏水洗后没有干燥
C.实验前装标准溶液的滴定管没有润洗
D.滴定后滴定管尖端有气泡
您最近一年使用:0次
解题方法
3 . 某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝。查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8 ℃升华,遇潮湿空气即产生大量白雾。用于有机合成和石油工业的催化剂,以及用于处理润滑油等。他们设计了以下装置,请结合题意回答问题:
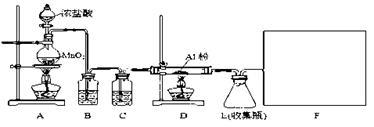
(1)A装置中发生反应的化学方程式为:_________________________
(2)装置B的作用是__________________________
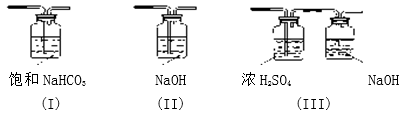
(3)请给标记为F的实线方框选择合适的装置_______
(4)AlCl3遇潮湿空气即产生大量白雾的原因是_________________ (结合化学方程式说明)。
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000 mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。
①若本实验需要NaOH标准溶液80mL,则配制该标准溶液需要用到玻璃仪器有玻璃棒,烧杯_______
②经计算,该次滴定测的试样中盐酸浓度为_______________ mol·L-1。
③在本实验的滴定过程中,下列操作会使实验结果偏小的是___________ (填写序号)。
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视

(1)A装置中发生反应的化学方程式为:
(2)装置B的作用是
(3)请给标记为F的实线方框选择合适的装置

(4)AlCl3遇潮湿空气即产生大量白雾的原因是
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000 mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。

①若本实验需要NaOH标准溶液80mL,则配制该标准溶液需要用到玻璃仪器有玻璃棒,烧杯
②经计算,该次滴定测的试样中盐酸浓度为
③在本实验的滴定过程中,下列操作会使实验结果偏小的是
| A.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失 |
| B.未用标准NaOH溶液润洗滴定管 |
| C.锥形瓶中加入待测盐酸后,再加少量水 |
| D.锥形瓶在滴定时剧烈摇动,有少量液体溅出 |
f.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次



