名校
1 . 已知溶液中存在平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )
Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )
①升高温度,平衡逆向移动 ②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下,向溶液中加入CaO,溶液的pH升高
⑤向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
 Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )
Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )①升高温度,平衡逆向移动 ②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下,向溶液中加入CaO,溶液的pH升高
⑤向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
| A.①⑥ | B.①⑤⑥ | C.②③④⑥ | D.①②⑥ |
您最近一年使用:0次
名校
2 . 有关AgCl的沉淀溶解平衡说法中正确的是( )
| A.AgCl沉淀生成和溶解不断进行,速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.AgCl悬浊液中加入NaCl固体,AgCl溶解度不变 |
| D.升温,AgCl沉淀的溶解度减小 |
您最近一年使用:0次
3 . 如图是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的沉淀溶解平衡曲线。下列有关说法正确的是( )
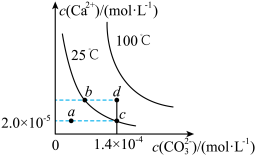

A.CaCO3(s) Ca2+(aq)+CO32—(aq) ΔH<0 Ca2+(aq)+CO32—(aq) ΔH<0 |
| B.a、b、c、d四点对应的溶度积Ksp相等 |
| C.25 ℃时CaCO3的Ksp=2.8×10-9 |
| D.温度不变,挥发水分,可使溶液由a点变到c点 |
您最近一年使用:0次
2019-12-07更新
|
219次组卷
|
11卷引用:山西省康杰中学2017-2018学年高二上学期期中考试化学试题
山西省康杰中学2017-2018学年高二上学期期中考试化学试题山西省吕梁市2020-2021学年高二上学期期末考试化学试题(已下线)2017-2018学年上学期期末复习备考之精准复习模拟题高二化学选修4(B卷)【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期中考试化学试题黑龙江省鹤岗市第一中学2019-2020学年高二上学期期中考试化学试题苏教版选修四化学反应原理专题3第四单元 难溶电解质的沉淀溶解平衡 同步检测试卷重庆市凤鸣山中学2018-2019学年高二上学期期中考试化学试题新疆伊犁新源县2021-2022学年高二上学期期末考试化学试题(已下线)解密13 沉淀溶解平衡——备战2018年高考化学之高频考点解密(已下线)2019年4月12日 《每日一题》三轮复习——难溶电解质溶解平衡江西省萍乡市莲花中学2019-2020高一下学期3月特色班月考化学试题
2019高二上·全国·专题练习
名校
4 . 已知:pAg=−lgc(Ag+),Ksp(AgCl)=1×10−12。如图是向10mLAgNO3溶液中逐渐加入0.1 mol·L−1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线)。根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
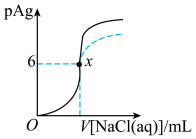

| A.原AgNO3溶液的物质的量浓度为0.1mol·L−1 |
| B.图中x点的坐标为(100,6) |
| C.图中x点表示溶液中Ag+被恰好完全沉淀 |
| D.把0.1 mol·L−1的NaCl换成0.1mol·L−1 NaI则图象在终点后变为虚线部分 |
您最近一年使用:0次
2019-11-12更新
|
740次组卷
|
5卷引用:山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题
山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题(已下线)2019年11月15日 《每日一题》人教版(选修4)——沉淀溶解平衡曲线及应用微专题(12) 电解质溶液中的两类特殊图像(已下线)第5讲 沉淀溶解平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)(已下线)题型27 沉淀溶解平衡常数及其应用图象
名校
解题方法
5 . 下表是25℃时五种物质的溶度积常数,下列有关说法错误的是
| 化学式 |  |  | CuS |  |  |
| 溶度积 | 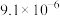 | 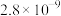 |  | 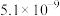 | 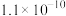 |
A.根据表中数据可推知,常温下 在纯水中的溶解度比 在纯水中的溶解度比 的大 的大 |
B.向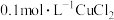 溶液中通入 溶液中通入 可生成CuS沉淀,是因为 可生成CuS沉淀,是因为 |
| C.根据表中数据可推知,向硫酸钡沉淀中加入饱和碳酸钠溶液,不可能有碳酸钡生成 |
D.常温下, 在 在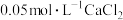 溶液中比在 溶液中比在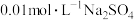 溶液中的溶解度小 溶液中的溶解度小 |
您最近一年使用:0次
2019-10-16更新
|
508次组卷
|
3卷引用:山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题
山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题(已下线)3.4.1 沉淀溶解平衡原理(基础练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)河南省安阳市2020届高三第一次调研考试化学试题
11-12高二下·福建泉州·期中
名校
6 . 一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) ⇌Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰后并恢复到原来的温度,下列说法正确的是
| A.溶液的pH增大 | B.溶液c(Ca2+)增大 |
| C.溶液中Ca2+离子数目减少 | D.溶液中溶质的质量分数增大 |
您最近一年使用:0次
2019-09-27更新
|
1767次组卷
|
18卷引用:山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题
山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题(已下线)2011-2012学年福建省南安一中高二下学期期中考试化学试卷(已下线)2011-2012学年山东省济宁市梁山一中高二下学期期中考试化学试卷 2014-2015辽宁省大连市第二十高中高二上学期期末化学试卷2014-2015重庆市杨家坪中学高二上学期第三次月考化学试卷2014-2015学年重庆市杨家坪中学高二上学期第三次月考化学试卷山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题2020年人教版高二化学选修4化学反应原理第三章《水溶液中的离子平衡》练习3-1鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时1 沉淀溶解平衡及其应用高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时1 溶解平衡及其应用湖北省黄冈市罗田县第一中学2020-2021学年高二10月月考化学试题吉林省公主岭市范家屯镇第一中学2020-2021学年高二上学期期末两校联考化学试题甘肃省天水市第一中学2020-2021学年高二下学期开学考试化学试题课时1 沉淀溶解平衡及其应用(已下线)3.4.1 难溶电解质的沉淀溶解平衡(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河南省安阳市第一中学2020-2021学年高二上学期期末考试化学试题宁夏回族自治区银川市北方民族大学附属中学2020-2021学年高二下学期3月月考化学试题甘肃省白银市靖远县第二中学2023-2024学年高二上学期12月期末化学试题
名校
7 . 某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是


| A.该温度下,Ksp(Ag2CrO4)=4×10-12 |
| B.al、b、c三点所示溶液中c(Ag+):al>b>c |
| C.若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点 |
| D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂 |
您最近一年使用:0次
2019-05-28更新
|
2767次组卷
|
8卷引用:山西省太原市山西大学附属中学2019-2020学年高二上学期12月月考化学试题
名校
8 . 在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是
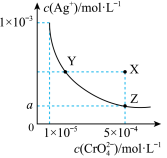

| A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等 |
| B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点 |
C.图中a= ×10-4 ×10-4 |
| D.T ℃时,Ag2CrO4的Ksp为1×10-8 |
您最近一年使用:0次
2019-04-27更新
|
652次组卷
|
12卷引用:山西省大同市第一中学2015-2016学年高二上12月月考化学试卷
山西省大同市第一中学2015-2016学年高二上12月月考化学试卷山西省晋城一中2017--2018学年度高二12月月考化学试题2015-2016学年福建省厦门市海沧中学高二下学期期末化学试卷湖南省醴陵市第一中学2018-2019学年高二(理)上学期期末考试化学试题【区级联考】山东省临沂市罗庄区2018-2019学年高二上学期期末考试化学试题【校级联考】湖北省宜昌市部分示范高中教学协作体2018-2019学年高二第二学期期中联考化学试题黑龙江省双鸭山市第一中学2020-2021学年高二第二次月考化学试题浙江省天台县育才中学2021-2022学年高二上学期第一次月考试卷化学试题北京市第二中学2022-2023学年高二上学期11月月考化学试题(已下线)3.4 沉淀溶解平衡-同步学习必备知识(已下线)2019年11月17日《每日一题》人教版(选修4)—— 每周一测四川省成都市北大成都附属实验学校2021届高三上学期12月月考理科综合化学试题
名校
9 . 下列关于难溶电解质溶解平衡的说法正确的是
| A.可直接根据Ksp的数值大小比较难溶电解质在水中的溶解度大小 |
| B.在AgCl的饱和溶液中,加入蒸馏水,Ksp(AgCl)不变 |
| C.难溶电解质的溶解平衡过程是可逆的,且在平衡状态时,v溶解=v沉淀=0 |
| D.25℃时,Ksp(AgCl)>Ksp(AgI),向 AgCl 的饱和溶液中加入少量KI固体,一定有黄色沉淀 |
您最近一年使用:0次
2019-03-20更新
|
574次组卷
|
6卷引用:【市级联考】山西省太原市2018-2019学年高二上学期期末考试化学试题
名校
10 . 已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mol·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图象(实线)。下列叙述正确的是
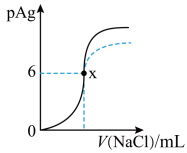

| A.原AgNO3溶液的物质的量浓度为0.1mol·L-1 |
| B.图中x点表示溶液中Ag+已经完全沉淀 |
| C.图中x点的坐标为(10,6) |
| D.若把NaCl溶液换成0.1mol·L-1NaI溶液,则图象在终点后变为虚线部分 |
您最近一年使用:0次
2019-02-14更新
|
943次组卷
|
9卷引用:山西省长治市第二中学2019-2020学年高二上学期期中考试化学试题
山西省长治市第二中学2019-2020学年高二上学期期中考试化学试题福建省福州市第八中学2016-2017学年高二下学期期末考试(理)化学试题【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二下学期第一次月考(开学)化学试题河北省武邑中学2019-2020学年高二12月月考化学试题(已下线)福建省霞浦第一中学2018-2019学年高二下学期第一次月考化学试题(B卷)【市级联考】福建省泉州市2019届高三上学期单科质量检查化学试题西藏自治区昌都市第一高级中学2020届高三下学期第一次模拟考试理综化学试题(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)甘肃省兰州市2019届高三二诊理综化学试题



