解题方法
1 . Ⅰ.研究铁的腐蚀,实验步骤如下:
步骤1:将铁粉放置于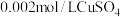 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。
步骤2:向 溶液(用盐酸调至
溶液(用盐酸调至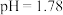 )中加入浸泡过的Fe粉。
)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。_______ 。
(2)第二、三阶段主要发生吸氧腐蚀。
①析氧腐蚀时Cu上发生的电极反应为_______ 。
②第一阶段和第二阶段发生不同种类腐蚀的主要影响因素是_______ 。
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知: 放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
①镀件Fe应与电源的_______ 相连。
②向 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将 转化为
转化为 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是_______ 。
(4)电镀后的废水中含有 ,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用
,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗 溶液
溶液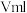 。
。
已知 (无色)
(无色) 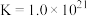
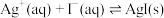 (黄色)
(黄色) 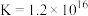
①滴定终点的现象是______________ 。
②废水中 的含量是
的含量是_______ g/L(用含C、V的代数式表示)。
步骤1:将铁粉放置于
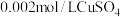 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。步骤2:向
 溶液(用盐酸调至
溶液(用盐酸调至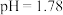 )中加入浸泡过的Fe粉。
)中加入浸泡过的Fe粉。步骤3:采集溶液pH随时间变化的数据。
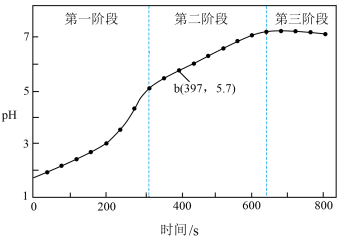
(2)第二、三阶段主要发生吸氧腐蚀。
①析氧腐蚀时Cu上发生的电极反应为
②第一阶段和第二阶段发生不同种类腐蚀的主要影响因素是
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知:
 放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。①镀件Fe应与电源的
②向
 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将 转化为
转化为 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是(4)电镀后的废水中含有
 ,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用
,一种测定其含量的方法是取废水50mL,再加KI溶液1mL,用 溶液滴定,达到滴定终点时,消耗
溶液滴定,达到滴定终点时,消耗 溶液
溶液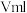 。
。已知
 (无色)
(无色) 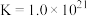
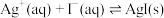 (黄色)
(黄色) 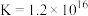
①滴定终点的现象是
②废水中
 的含量是
的含量是
您最近一年使用:0次
名校
解题方法
2 . 用如图所示装置分别进行实验,请回答下列问题:

(1)导管E的作用是:____________________ 、_________________ ;
(2)实验I烧瓶B中发生反应的化学方程式是________ ,产生的气体经验纯后点燃,现象是___________ ;
(3)实验Ⅱ剩余的NH3需吸收处理。以下各种尾气吸收装置中,不能防止倒吸的是___________ ;

(4)实验III的实验目的是验证生铁在潮湿空气中会发生吸氧腐蚀。则A中试剂可选用__________ (填序号);
a NaOH溶液 b C2H5OH c NaCl溶液 d 稀硫酸
能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_________ ;
(5)写出实验IV中发生反应的离子方程式_________ ;若读数时C管液面低于D管液面,则测出的镁铝合金中镁的质量分数将_______ (填“偏高”、“偏低”或“无影响”)。

| 实验 | A中试剂 | B中试剂 | C中液体 |
| I | 饱和食盐水 | 电石 | H2O |
| II | 浓氨水 | NaOH固体 | CCl4 |
| III | 生铁 | H2O | |
| IV | NaOH溶液 | 镁铝合金 | H2O |
(2)实验I烧瓶B中发生反应的化学方程式是
(3)实验Ⅱ剩余的NH3需吸收处理。以下各种尾气吸收装置中,不能防止倒吸的是

(4)实验III的实验目的是验证生铁在潮湿空气中会发生吸氧腐蚀。则A中试剂可选用
a NaOH溶液 b C2H5OH c NaCl溶液 d 稀硫酸
能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是
(5)写出实验IV中发生反应的离子方程式
您最近一年使用:0次
2020-03-21更新
|
82次组卷
|
2卷引用:上海市闸北区2016届高三4月期中练习(二模)化学试题
2014·上海崇明·二模
解题方法
3 . 阅读下列材料,完成相应填空。
合金是建造航空母舰的主体材料。如:航母舰体可由合金钢制造,航母升降机可由铝合金制造,航母螺旋桨主要用铜合金制造。
(1)Al原子核外电子占据___ 个纺锤形轨道;Fe原子核外电子排布式为1s22s22p63s23p63d64s2,铁原子核外有___ 种能量不同的电子。
(2)下列事实可用作比较Al和Fe金属性强弱依据的是( )
A. Al的导电性、导热性比Fe更好
B. Al(OH)3可溶于NaOH溶液,Fe(OH)3不溶于NaOH溶液
C. 相同质量的Al片和Fe片,投入到等浓度的稀硫酸溶液中,Al片产生氢气更多
D. 在野外利用铝热剂焊接铁轨
(3)航母在海洋中行驶时,舰体发生的电化学腐蚀类型为:___ ,其中正极发生的电极反应式为:___ 。
(4)取a克Cu—Al合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,则合金中Cu的质量分数为___ 。
(5)Al—Mg合金焊接前用NaOH溶液处理铝表面Al2O3膜,其化学方程式为:___ 。
(6)取适量Al—Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应。
下列叙述正确的是( )
A. Mg作负极,Al作正极
B. 该反应速率比纯铝与NaOH溶液的反应速率快
C. 若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2
D. 若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少
合金是建造航空母舰的主体材料。如:航母舰体可由合金钢制造,航母升降机可由铝合金制造,航母螺旋桨主要用铜合金制造。
(1)Al原子核外电子占据
(2)下列事实可用作比较Al和Fe金属性强弱依据的是
A. Al的导电性、导热性比Fe更好
B. Al(OH)3可溶于NaOH溶液,Fe(OH)3不溶于NaOH溶液
C. 相同质量的Al片和Fe片,投入到等浓度的稀硫酸溶液中,Al片产生氢气更多
D. 在野外利用铝热剂焊接铁轨
(3)航母在海洋中行驶时,舰体发生的电化学腐蚀类型为:
(4)取a克Cu—Al合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,则合金中Cu的质量分数为
(5)Al—Mg合金焊接前用NaOH溶液处理铝表面Al2O3膜,其化学方程式为:
(6)取适量Al—Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应。
下列叙述正确的是
A. Mg作负极,Al作正极
B. 该反应速率比纯铝与NaOH溶液的反应速率快
C. 若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2
D. 若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少

您最近一年使用:0次
名校
解题方法
4 . 下列叙述正确的是
| A.纯铁为灰黑色,属于黑色金属 | B.铁元素是自然界中含量最多的金属元素 |
| C.铁粉在氧气中燃烧生成氧化铁 | D.铁在潮湿环境中更容易生锈 |
您最近一年使用:0次
2021-09-29更新
|
375次组卷
|
2卷引用:上海市上海交通大学附属中学2020-2021学年高二上学期期中考试试题
5 . 根据下列实验方案进行实验,能达到相应实验目的是
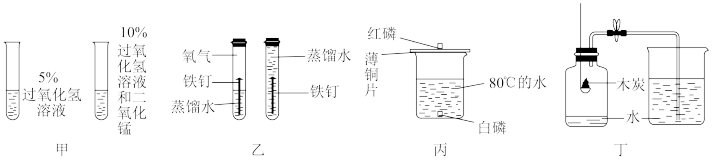

| A.装置甲探究MnO2对H2O2分解的催化作用 |
| B.装置乙探究铁钉生锈时O2是否参与反应 |
| C.装置丙比较红磷和白磷的着火点 |
| D.装置丁测定空气中O2的含量 |
您最近一年使用:0次
2021-10-13更新
|
90次组卷
|
2卷引用:上海交通大学附属中学2022-2023学年高一上学期开学摸底考试化学试题
2012·上海·零模
6 . 如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是


| A.稀硫酸对Fe-Cr合金的腐蚀性比稀硝酸和稀盐酸都强 |
| B.随着Fe含量的增加,Fe-Cr合金在5%HNO3中的耐腐蚀性越来越弱 |
C.Cr含量等于13%时,三种酸对Fe-Cr合金的腐蚀速率由快到慢的顺序为 |
| D.Cr含量小于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |
您最近一年使用:0次
2011·浙江·高考真题
真题
名校
7 . 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是()


| A.液滴中的Cl–由a区向b区迁移 |
| B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH−形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+ |
您最近一年使用:0次
2019-01-30更新
|
1723次组卷
|
34卷引用:上海市卢湾区2012届高三上学期期末考试化学试题
(已下线)上海市卢湾区2012届高三上学期期末考试化学试题上海市上海中学2021届高三上学期期中考试化学试题2011年普通高等学校招生全国统一考试化学卷(浙江)(已下线)2011-2012学年浙江东阳中学、兰溪一中高二下学期期中考试化学卷(已下线)2011-2012学年吉林省扶余一中高一下学期期中考试化学试卷(已下线)2011-2012学年河南省信阳高中高一下学期期中考试化学试卷(已下线)2013届山西省山大附中高三1月月考化学试卷(已下线)2012-2013学年湖北省黄冈中学高二上学期期中考试化学试卷(已下线)2012届北京市清华附中高三考前适应性训练理综化学试卷2015-2016学年浙江省温州市瑞安市龙翔中学高二上第三次月考化学卷2015-2016学年北大附中河南分校高一下3月月考化学试卷浙江省温州中学2016-2017学年高一下学期期中考试化学试题河南省南阳市第一中学校2016-2017学年高二下学期第三次月考化学试题河南省南阳市第一中学2016-2017学年高二下学期第三次月考化学试题宁夏育才中学学益校区2017-2018学年高二12月月考化学试题山东省新汶中学2017-2018学年高二上学期第一次月考化学试题河南省郑州市第二中学2018-2019学年高二上学期第一次月考化学试题高二人教版选修4 第四章 第四节 金属的电化学腐蚀与防护(已下线)2018年12月15日 《每日一题》人教选修4-周末培优河南省鹤壁市高级中学2018-2019学年高一下学期第二次段考化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题16 金属的腐蚀与防护甘肃省兰州市第一中学2019-2020学年高二上学期期末考试化学试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第4节 金属的腐蚀与防护人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第三节 金属的腐蚀与防护 教材帮福建省永安市第三中学2020-2021学年高二10月月考化学(选考班)试题河南省郑州励德双语学校2020-2021学年高二上学期期中考试化学试题(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)新疆柯坪县柯坪湖州国庆中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题08 电化学之电解池-【微专题·大素养】备战2022年高考化学讲透提分要点河南省信阳高级中学2021-2022学年高二下学期4月月考化学试题四川省遂宁市第二中学校2021-2022学年高二下学期半期考试化学试题内蒙古包头市2022-2023学年高二上学期期末考试化学试题山西大学附属中学校2022-2023学年高二上学期12月月考化学试题重庆市南开中学2023-2024学年高二上学期期末考试化学试题
2018高二·全国·专题练习
8 . 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气的含量比边缘的少。下列说法正确的是


| A.液滴下氧气的含量少,发生析氢腐蚀 |
| B.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由(a)区向(b)区迁移,与(b)区的OH−形成Fe(OH)2,进一步被氧化、脱水形成铁锈 |
C.液滴边缘是正极区,发生的电极反应为O2+2H2O+4e− 4OH− 4OH− |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e− Cu2+ Cu2+ |
您最近一年使用:0次
12-13高三上·上海闵行·期末
9 . 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),
如图所示。导致该现象的主要原因是液滴下面的氧气
含量比液滴边缘少。下列说法正确的是

如图所示。导致该现象的主要原因是液滴下面的氧气
含量比液滴边缘少。下列说法正确的是

| A.(a)区腐蚀比(b)区腐蚀严重 |
| B.该过程发生了化学反应:4Fe+3O2=2Fe2O3 |
| C.该过程是析氢腐蚀,负极反应为:Fe-2e- =Fe2+ |
| D.该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH- |
您最近一年使用:0次



