名校
解题方法
1 . 回答下列问题。
(1) ,
, 的
的 溶液中,由水电离出的
溶液中,由水电离出的 浓度约为
浓度约为_________  。
。
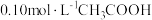 溶液加适量的水稀释,下列表达式的数值变大的是
溶液加适量的水稀释,下列表达式的数值变大的是__________ (填标号)。
A. B.
B.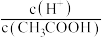 C.
C. D.
D.
(2)如图烧杯中盛的是海水,铁腐蚀的速率最慢的是__________(填标号)。
(3)用如图所示的装置研究电化学的相关问题(乙装置中X为阳离子交换膜)。

①甲装置中负极反应式为______________________________ 。
②乙装置中石墨电极上生成的气体为____________________ (填化学式)。
③丙装置中 足量,工作一段时间后,溶液的
足量,工作一段时间后,溶液的
__________ (填“变大”、“变小”或不变),反应的化学方程式为____________________ ,若要将电解后的溶液复原,需加入一定量的__________ (填化学式)。
(4)常温下,用 溶液作
溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 ,写出得到
,写出得到 的离子方程式:
的离子方程式:____________________ ,若某次捕捉后得到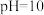 的溶液,则溶液中
的溶液,则溶液中
__________ ,[常温下 ]
]
(1)
 ,
, 的
的 溶液中,由水电离出的
溶液中,由水电离出的 浓度约为
浓度约为 。
。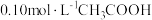 溶液加适量的水稀释,下列表达式的数值变大的是
溶液加适量的水稀释,下列表达式的数值变大的是A.
 B.
B.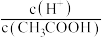 C.
C. D.
D.
(2)如图烧杯中盛的是海水,铁腐蚀的速率最慢的是__________(填标号)。
A. | B. | C.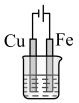 | D. |
(3)用如图所示的装置研究电化学的相关问题(乙装置中X为阳离子交换膜)。

甲 乙 丙
①甲装置中负极反应式为
②乙装置中石墨电极上生成的气体为
③丙装置中
 足量,工作一段时间后,溶液的
足量,工作一段时间后,溶液的
(4)常温下,用
 溶液作
溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 ,写出得到
,写出得到 的离子方程式:
的离子方程式: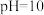 的溶液,则溶液中
的溶液,则溶液中
 ]
]
您最近一年使用:0次
名校
解题方法
2 . (1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________ (填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________ kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________ mol/(L·s);
②若将该容器置于冰水中,气体颜色将________ (填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________ 。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-⇌H++SO32- Ka2
HSO3-+H2O⇌H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________ (填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______ c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
①几分钟后,可观察到导管中的水柱________ ;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________ ;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________ 。
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:
②CO(g)+1/2O2(g)=CO2(g) ΔH=
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)
 N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:①5秒内,v(NO2)=
②若将该容器置于冰水中,气体颜色将
③该反应的平衡常数表达式K=
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-⇌H++SO32- Ka2
HSO3-+H2O⇌H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈
②溶液中c(Na+)
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
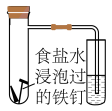
①几分钟后,可观察到导管中的水柱
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为
您最近一年使用:0次
2019-03-24更新
|
352次组卷
|
5卷引用:重庆市乌江新高考协作体2023-2024学年高二上学期1月期末化学试题



