1 . 化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
(2)化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。

①该同学设计这两个实验的目的是___________ 。
②有关反应一段时间后的实验现象,下列说法正确的是___________ ( 填字母)。
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为___________ ,工作时间内装置所产生氢气的体积为 ___________ L(标准状况)。
(1)原电池是一种化学能转变为电能的装置,所以原电池的设计原理与某类化学反应有关。你认为下列化学反应,可以设计成原电池的是___________(填字母)。
| A.CaO+H2O=Ca(OH)2 |
B.C+CO2 2CO 2CO |
| C.NaOH+HCl=NaCl+H2O |
| D.2FeCl3+Cu=2FeCl2+CuCl2 |

①该同学设计这两个实验的目的是
②有关反应一段时间后的实验现象,下列说法正确的是
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温。
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比1慢
(3)若将用导线相连在一起,总质量为80.00 g的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g,则装置工作时锌片上的电极反应式为
您最近一年使用:0次
2022-05-28更新
|
969次组卷
|
5卷引用:山西省运城市2021-2022学年高一下学期5月联考化学试题
山西省运城市2021-2022学年高一下学期5月联考化学试题山东省济宁市曲阜孔子高级中学2022-2023学年高一下学期4月月考化学试题(已下线)化学(人教版2019B卷)-学易金卷:2022-2023学年高一下学期期中考前必刷卷第六章 化学反应与能量(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第六章 化学反应与能量【单元测试B卷】
解题方法
2 . 电池和电解池在日常生活中有着广泛的应用。
(1) 干电池应用广泛,其电解质溶液是
干电池应用广泛,其电解质溶液是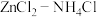 混合溶液。该电池的负极材料是
混合溶液。该电池的负极材料是___________ ,电池工作时,电子流向___________ (填“正极”或“负极”)。若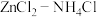 混合溶液中含有杂质
混合溶液中含有杂质 ,会加速某电极的反应,形成“自放电”现象,其主要原因是
,会加速某电极的反应,形成“自放电”现象,其主要原因是___________ 。
(2)铅蓄电池是常用的化学电源,其电极材料分别是 和
和 ,电解质溶液为硫酸。该电池总反应式为:
,电解质溶液为硫酸。该电池总反应式为: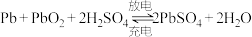 。请根据上述情况判断:该蓄电池放电时,
。请根据上述情况判断:该蓄电池放电时, 发生
发生___________ (填“氧化”或“还原”)反应;正极附近溶液的酸性___________ (填“增强”、“减弱”或“不变”);充电时,电解质溶液中阴离子移向___________ (填“ ”或“
”或“ ”)电极,阴极的电极反应式为
”)电极,阴极的电极反应式为___________ 。
(3)按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。
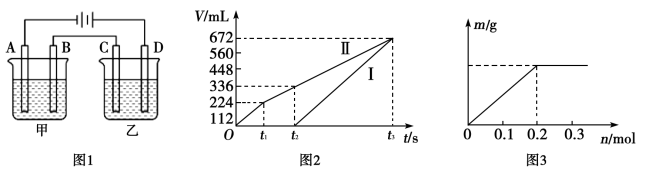
已知一:甲槽电解的是 一定浓度的
一定浓度的 与
与 的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。原混合溶液中
的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。原混合溶液中 的物质的量浓度为
的物质的量浓度为___________  。
。
已知二:若乙槽为 溶液,通电一段时间后,向所得的乙槽溶液中加入
溶液,通电一段时间后,向所得的乙槽溶液中加入 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为___________ (用 表示)。
表示)。
已知三:若乙槽中溶液的溶质为 和
和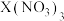 ,且均为
,且均为 。通电一段时间后,阴极析出固体质量m与通过电子的物质的量n关系如图所示,则
。通电一段时间后,阴极析出固体质量m与通过电子的物质的量n关系如图所示,则 、
、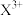 、
、 氧化能力由大到小的顺序是
氧化能力由大到小的顺序是___________ 。
(1)
 干电池应用广泛,其电解质溶液是
干电池应用广泛,其电解质溶液是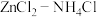 混合溶液。该电池的负极材料是
混合溶液。该电池的负极材料是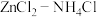 混合溶液中含有杂质
混合溶液中含有杂质 ,会加速某电极的反应,形成“自放电”现象,其主要原因是
,会加速某电极的反应,形成“自放电”现象,其主要原因是(2)铅蓄电池是常用的化学电源,其电极材料分别是
 和
和 ,电解质溶液为硫酸。该电池总反应式为:
,电解质溶液为硫酸。该电池总反应式为: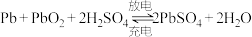 。请根据上述情况判断:该蓄电池放电时,
。请根据上述情况判断:该蓄电池放电时, 发生
发生 ”或“
”或“ ”)电极,阴极的电极反应式为
”)电极,阴极的电极反应式为(3)按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。

已知一:甲槽电解的是
 一定浓度的
一定浓度的 与
与 的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。原混合溶液中
的混合溶液,理论上两极所得气体体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。原混合溶液中 的物质的量浓度为
的物质的量浓度为 。
。已知二:若乙槽为
 溶液,通电一段时间后,向所得的乙槽溶液中加入
溶液,通电一段时间后,向所得的乙槽溶液中加入 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为 表示)。
表示)。已知三:若乙槽中溶液的溶质为
 和
和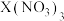 ,且均为
,且均为 。通电一段时间后,阴极析出固体质量m与通过电子的物质的量n关系如图所示,则
。通电一段时间后,阴极析出固体质量m与通过电子的物质的量n关系如图所示,则 、
、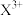 、
、 氧化能力由大到小的顺序是
氧化能力由大到小的顺序是
您最近一年使用:0次
名校
解题方法
3 . 人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息,填写空格由A、B、C、D四种金属按下表中装置进行实验:
(1)装置甲中SO 向
向____ 极移动(填“A”或“B”)。
(2)四种金属活动性由强到弱的顺序是____ 。
(3)请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,正极上出现的现象是____ 。若导线上转移电子1mol,则生成银____ g,理论上电解质溶液质量变化____ g。
(4)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
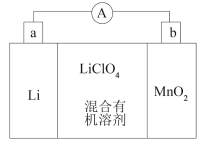
①外电路的电流方向是由____ 极流向____ 极(填字母)。
②电池正极反应式为____ 。
| 装置 | 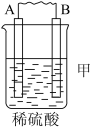 |  | 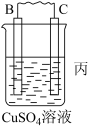 |
| 现象 | B上有气体产生 | D不断溶解 | C质量增加 |
 向
向(2)四种金属活动性由强到弱的顺序是
(3)请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,正极上出现的现象是
(4)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

①外电路的电流方向是由
②电池正极反应式为
您最近一年使用:0次
名校
解题方法
4 . 某兴趣小组用如图所示装置研究电化学相关问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转,根据所学知识回答下列问题。
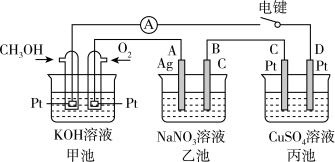
(1)闭合电键后,乙池NO 去向
去向_______ 极(填“A”或“B”),丙池中D电极为_______ 极(填“正”、“负” 、“阴”或“阳”)。
(2)乙池中A电极的现象为_______ 。
(3)写出CH3OH电极的电极反应式_______ 。
(4)写出丙池中总反应的离子方程式_______ 。
(5)丙池中析出固体铜1.60g时,甲池中理论上消耗O2的体积_______  (标准状况下)。
(标准状况下)。

(1)闭合电键后,乙池NO
 去向
去向(2)乙池中A电极的现象为
(3)写出CH3OH电极的电极反应式
(4)写出丙池中总反应的离子方程式
(5)丙池中析出固体铜1.60g时,甲池中理论上消耗O2的体积
 (标准状况下)。
(标准状况下)。
您最近一年使用:0次
解题方法
5 . 随着新能源汽车销量逐年攀升,动力电池的制备和回收利用技术至关重要。利用含 的锂电池废料回收制备
的锂电池废料回收制备 的流程图如下:
的流程图如下:
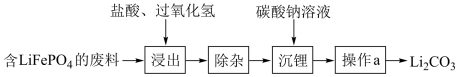
(1)含 的废料在浸出操作之前要进行粉碎,其作用是
的废料在浸出操作之前要进行粉碎,其作用是_______ 。
(2)浸出过程中温度不宜高于40℃,原因是_______ 。
(3)操作a的名称为_______ 。
(4)欲证明 产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)
产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)_______ °
(5)工业通过处理含 的废旧电池正极材料可以回收Li,Li可用于空气中
的废旧电池正极材料可以回收Li,Li可用于空气中 的固定,其工作原理为:
的固定,其工作原理为: 。该电池的正极反应式为
。该电池的正极反应式为_______ 。反应中当有3 mol氧化剂被还原,通过交换膜的 的物质的量为
的物质的量为_______ mol。
 的锂电池废料回收制备
的锂电池废料回收制备 的流程图如下:
的流程图如下:
(1)含
 的废料在浸出操作之前要进行粉碎,其作用是
的废料在浸出操作之前要进行粉碎,其作用是(2)浸出过程中温度不宜高于40℃,原因是
(3)操作a的名称为
(4)欲证明
 产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)
产品中是否含LiCl,简述实验方法(包括步骤、试剂、现象和结论等)(5)工业通过处理含
 的废旧电池正极材料可以回收Li,Li可用于空气中
的废旧电池正极材料可以回收Li,Li可用于空气中 的固定,其工作原理为:
的固定,其工作原理为: 。该电池的正极反应式为
。该电池的正极反应式为 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
6 . 电解原理在化学工业中有广泛的应用。如图所示为一电解池装置,U形管内装有电解液c,A、B是两块电极板,通过导线与直流电源相连。
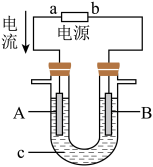
(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:
①a电极是_______ 极(填“正”或“负”),B电极是_______ 极(填“阴”或“阳”);
②A电极产生的气体为____ ,B电极周围的现象____ ,B电极的电极反应式为____ ;
③检验A电极上产物的试剂是:_______ ,发生的反应是_______ 。
(2)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2g,常温下,若将电解后的溶液稀释至1L,则溶液中H2SO4的浓度约为_______ 。

(1)若A、B都是惰性电极,电解质溶液c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试剂,试判断:
①a电极是
②A电极产生的气体为
③检验A电极上产物的试剂是:
(2)若图示装置为用惰性电极电解CuSO4溶液的装置,其中阴极上析出Cu的质量为3.2g,常温下,若将电解后的溶液稀释至1L,则溶液中H2SO4的浓度约为
您最近一年使用:0次
名校
7 . I.如图所示,某同学设计了一个燃料电池并进行电解实验,请回答下列问题:

(1)甲池中通____ (填“氧气”或“甲烷”)的是负极,其电极反应式为____ 。
(2)标准状况下,若有2.24L氧气参加反应,则乙装置中铁电极上生成气体的物质的量为____ mol。
(3)丙池中铜片上可观察到的现象为____ 。
II.据报道,我国已研制出“可充室温钠-二氧化碳电池”,如图所示,该电池的工作原理为4Na+3CO2 Na2CO3+C(放电时产生的Na2CO3固体贮存于多壁碳纳米管中)。
Na2CO3+C(放电时产生的Na2CO3固体贮存于多壁碳纳米管中)。

(4)放电时,钠箔为该电池的____ 极(填“正”或“负”):电解质溶液中ClO 流向
流向____ (填“钠箔”或“多壁碳纳米管”)电极。
(5)充电时,多糖碳纳米管连接直流电源的____ (填“正”或“负”)极,其电极反应式为____ 。

(1)甲池中通
(2)标准状况下,若有2.24L氧气参加反应,则乙装置中铁电极上生成气体的物质的量为
(3)丙池中铜片上可观察到的现象为
II.据报道,我国已研制出“可充室温钠-二氧化碳电池”,如图所示,该电池的工作原理为4Na+3CO2
 Na2CO3+C(放电时产生的Na2CO3固体贮存于多壁碳纳米管中)。
Na2CO3+C(放电时产生的Na2CO3固体贮存于多壁碳纳米管中)。
(4)放电时,钠箔为该电池的
 流向
流向(5)充电时,多糖碳纳米管连接直流电源的
您最近一年使用:0次
名校
解题方法
8 . 我国科研人员利用微生物将废水中的尿素(CONH2)2]的化学能直接转化为电能,生成对环境友好的物质,并利用该能源实现精炼铜和电解饱和CuSO4溶液等用途。

回答下列问题:
(1)乙池是精炼铜的装置,A电极应与_______ 极(填“X”或“Y”)相连, 电极方程式:_______ (已知粗铜中含有Zn、Ag等杂质),C溶液的浓度会_______ (填“增大”,“减少”,“不变”)。
(2)M极发生的电极反应式为_______ ;若B电极上的质量增加1.92g,则甲装置中消耗CO(NH2)2的质量为_______ 。
(3)常温下,利用甲池与丙池连接电解CuSO4溶液,若D与X相连,E电极上发生的电极反应式:_______ ;通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移电子的物质的量为_______ mol。(忽略溶液体积变化)
(4)利用如图装置,可以模拟铁的电化学防护。

①若X为石墨,为减缓铁的腐蚀,将开关K置于N处,该电化学防护法称为_______ ,若X为锌,开关K置于M处,该电化学防护法称为_______ 。
②若X为锌,K置于M处,设计实验证明Fe电极被保护:所用试剂为_______ ,若Fe电极被保护,则不应该出现_______ 现象。

回答下列问题:
(1)乙池是精炼铜的装置,A电极应与
(2)M极发生的电极反应式为
(3)常温下,利用甲池与丙池连接电解CuSO4溶液,若D与X相连,E电极上发生的电极反应式:
(4)利用如图装置,可以模拟铁的电化学防护。

①若X为石墨,为减缓铁的腐蚀,将开关K置于N处,该电化学防护法称为
②若X为锌,K置于M处,设计实验证明Fe电极被保护:所用试剂为
您最近一年使用:0次
9 . 环状碳酸酯( )是一种重要的工业原料,可用作锂离子电池电解质的溶剂。一种由苯乙烯经电解制备环状碳酸酯的实验操作如下。
)是一种重要的工业原料,可用作锂离子电池电解质的溶剂。一种由苯乙烯经电解制备环状碳酸酯的实验操作如下。
ⅰ.将一定量电解质、苯乙烯、水-二甲亚砜溶剂依次放入塑料烧杯中,搅拌均匀后放入高压反应釜内,充入一定量CO2气体:
ⅱ.以石墨和铜片为两个电极,电解至苯乙烯完全消耗后,停止电解:
ⅲ.分离、提纯产品,计算产率。
在相同条件下,采用不同电解质进行实验I~IV,实验结果如表:
已知:ⅰ.电解效率η(B)= ×100%
×100%
ⅱ.I2在碱性环境中会歧化为I-和IO 。
。
(1)针对实验III进行如下分析:
①取反应后石墨电极附近溶液滴加淀粉溶液变蓝,则石墨作____ 极(填“阳”或“阴”)。
②苯乙烯与石墨电极上生成的物质发生反应,得到中间产物1—苯基—2—碘乙醇( ),写出可能存在的有机副产物的结构简式
),写出可能存在的有机副产物的结构简式____ 。
③1—苯基—2—碘乙醇在一定条件下转化为苯基环氧乙烷(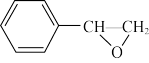 ),后者对CO2进行加成反应,得到的环状碳酸酯的结构简式为
),后者对CO2进行加成反应,得到的环状碳酸酯的结构简式为____ 。
④已知η(环状碳酸酯)≈63%,则电路中通过1mol电子时,产生___ mol环状碳酸酯。
(2)对比实验I~III可知,其他条件相同时,电解质分别选用NH4Cl、NH4Br、NH4I时,环状碳酸酯的产率依次显著升高,从原子结构角度解释,是因为____ ,导致Cl-、Br-、I-的放电能力依次增强。
(3)探究实验IV中未生成环状碳酸酯的原因,继续实验。
①实验IV中阴极产生气体的电极反应式为____ 。
②经X光单晶衍射实验证实,实验Ⅳ中得到的白色固体含NaIO3•H2O,用化学用语解释得到该物质的原理____ 。
③设计实验方案检测白色固体中的NaIO3•H2O,取少量白色固体溶于水,加稀硫酸酸化后,_____ 。可选试剂:Na2SO3溶液、KI溶液、淀粉溶液、CCl4。
 )是一种重要的工业原料,可用作锂离子电池电解质的溶剂。一种由苯乙烯经电解制备环状碳酸酯的实验操作如下。
)是一种重要的工业原料,可用作锂离子电池电解质的溶剂。一种由苯乙烯经电解制备环状碳酸酯的实验操作如下。ⅰ.将一定量电解质、苯乙烯、水-二甲亚砜溶剂依次放入塑料烧杯中,搅拌均匀后放入高压反应釜内,充入一定量CO2气体:
ⅱ.以石墨和铜片为两个电极,电解至苯乙烯完全消耗后,停止电解:
ⅲ.分离、提纯产品,计算产率。
在相同条件下,采用不同电解质进行实验I~IV,实验结果如表:
| 实验序号 | 电解质 | 产率/% | 实验现象 |
| I | NH4Cl | 微量 | 阴极产生气体,能使湿润的红色石蕊试纸变蓝 |
| II | NH4Br | 68 | |
| III | NH4I | 95 | |
| IV | NaI | 0 | 阴极产生气体;阳极附近有白色固体析出 |
 ×100%
×100%ⅱ.I2在碱性环境中会歧化为I-和IO
 。
。(1)针对实验III进行如下分析:
①取反应后石墨电极附近溶液滴加淀粉溶液变蓝,则石墨作
②苯乙烯与石墨电极上生成的物质发生反应,得到中间产物1—苯基—2—碘乙醇(
 ),写出可能存在的有机副产物的结构简式
),写出可能存在的有机副产物的结构简式③1—苯基—2—碘乙醇在一定条件下转化为苯基环氧乙烷(
 ),后者对CO2进行加成反应,得到的环状碳酸酯的结构简式为
),后者对CO2进行加成反应,得到的环状碳酸酯的结构简式为④已知η(环状碳酸酯)≈63%,则电路中通过1mol电子时,产生
(2)对比实验I~III可知,其他条件相同时,电解质分别选用NH4Cl、NH4Br、NH4I时,环状碳酸酯的产率依次显著升高,从原子结构角度解释,是因为
(3)探究实验IV中未生成环状碳酸酯的原因,继续实验。
①实验IV中阴极产生气体的电极反应式为
②经X光单晶衍射实验证实,实验Ⅳ中得到的白色固体含NaIO3•H2O,用化学用语解释得到该物质的原理
③设计实验方案检测白色固体中的NaIO3•H2O,取少量白色固体溶于水,加稀硫酸酸化后,
您最近一年使用:0次
解题方法
10 . 为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。
Ⅰ.用图甲所示装置进行第一组实验时:
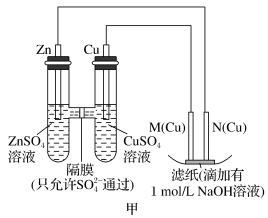
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_______(填字母)。
(2)实验过程中,
_______ (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是_______ 。
Ⅱ.该小组同学用图乙所示装置打算进行二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根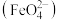 在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
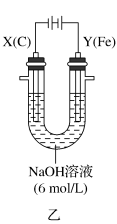
(3)电解过程中,X极处溶液的 浓度
浓度_______ (填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为 和
和_______ 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电板(铁电极)质量减小0.28g,则在Y极收集到气体为_______ mL(均已折算为标准状况时气体体积)。
(6)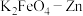 也可以组成碱性电池,
也可以组成碱性电池, 在电池中作为正极材料,其电池反应总反应式为
在电池中作为正极材料,其电池反应总反应式为 ,该电池正极发生的电极反应式为
,该电池正极发生的电极反应式为_______ 。
Ⅰ.用图甲所示装置进行第一组实验时:

(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_______(填字母)。
| A.石墨 | B.镁 | C.银 | D.铂 |

Ⅱ.该小组同学用图乙所示装置打算进行二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根
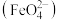 在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的
 浓度
浓度(4)电解过程中,Y极发生的电极反应为
 和
和(5)电解进行一段时间后,若在X极收集到672mL气体,Y电板(铁电极)质量减小0.28g,则在Y极收集到气体为
(6)
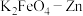 也可以组成碱性电池,
也可以组成碱性电池, 在电池中作为正极材料,其电池反应总反应式为
在电池中作为正极材料,其电池反应总反应式为 ,该电池正极发生的电极反应式为
,该电池正极发生的电极反应式为
您最近一年使用:0次



