名校
1 . 某化学兴趣小组的同学设计了锌铜原电池装置如图所示。下列说法错误的是
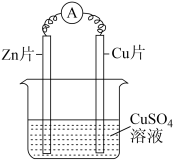
| A.电子从锌片经导线流向铜片 |
| B.电池工作时,铜电极上发生氧化反应 |
| C.电池工作一段时间后,锌片质量减小 |
D.该装置能证明金属的活动性: |
您最近一年使用:0次
2023-05-03更新
|
303次组卷
|
3卷引用:河北省衡水市枣强中学2023-2024学年高一下学期第二次调研考试化学试题
名校
解题方法
2 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 比较Cu和Ag的金属性 | 将银棒和铜棒分别插入AgNO3溶液与CuSO4溶液中,并用盐桥和导线(含电流表)将二者连接组成原电池 |
| B | 验证KI溶液与FeCl3溶液之间的反应为可逆反应 | 取2mL0.1mol/LKI溶液,加入5~6滴FeCl3溶液充分反应,再滴入2滴淀粉溶液 |
| C | 证明苯能与液溴发生取代反应 | 将苯与液溴反应生成的气体直接通入AgNO3溶液中 |
| D | 证明pH(CuSO4)随温度升高而增大 | 用pH计分别测量40℃和70℃时0.1mol/LCuSO4溶液的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 下列实验装置能达到相应实验目的的是
| A | B | C | D |
 |  |  |  |
| 证明金属性:Mg>Al | 制备 固体 固体 | 证明非金属性:Cl>C>Si | 证明 有还原性 有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-26更新
|
361次组卷
|
3卷引用:选择题1-5
名校
解题方法
4 . 下表中实验操作、实验现象与结论对应关系均正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A. | 等体积 的两种酸HX和HY的溶液分别与足量的锌反应 的两种酸HX和HY的溶液分别与足量的锌反应 | HX溶液中放出的 多 多 | HX的酸性比HY强 |
| B. | 用广泛pH试纸测定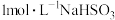 溶液的酸碱性 溶液的酸碱性 | 测得 |  溶液呈酸性,证明 溶液呈酸性,证明 在水中的电离程度大于水解程度 在水中的电离程度大于水解程度 |
| C. | 将银和硝酸银溶液与铜和硫酸钠溶液组成原电池,用导线连通 | 银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 | 铜的金属性比银强 |
| D. | 向10mL浓度为 的 的 溶液中先滴加少量的NaCl溶液,再滴加少量的NaI溶液 溶液中先滴加少量的NaCl溶液,再滴加少量的NaI溶液 | 先产生白色沉淀,再产生黄色沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题
(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。为达到目的,其中石墨为___________ 极,甲溶液是___________ ,证明反应Ag++Fe2+=Ag+Fe3+能够发生的实验操作及现象是___________

(2)用零价铁(Fe)去除水体中的硝酸盐(NO )已成为环境修复研究的热点之一,Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一,Fe还原水体中NO3-的反应原理如图所示。

上图中作负极的物质是___________ 。正极的电极反应式是___________ 。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为___________ 。 电路中转移1 mol电子,需消耗氧气___________ L(标准状况)。

(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。为达到目的,其中石墨为

(2)用零价铁(Fe)去除水体中的硝酸盐(NO
 )已成为环境修复研究的热点之一,Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一,Fe还原水体中NO3-的反应原理如图所示。
上图中作负极的物质是
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为

您最近一年使用:0次
6 . 根据要求回答下列问题:
反应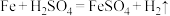 的能量变化趋势如图所示。
的能量变化趋势如图所示。
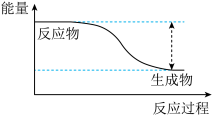
(1)该反应为___________ (填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施不可行的是___________(填字母)。
(3)欲区分葡萄糖和淀粉,可选用___________(填字母,下同)。
(4)氮的化合物常用作制冷剂的是___________ (填名称),向蔗糖中滴加少量浓硫酸并搅拌,出现“黑色面包”,并产生刺激性无色气体,这一现象显示浓硫酸的___________ (填性质)。
(5)燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为 )等污染物,工业上采用
)等污染物,工业上采用 碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为
碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为___________ ,实验证明相对于 ,
, 更难脱除,其原因可能是
更难脱除,其原因可能是___________ 。
反应
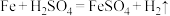 的能量变化趋势如图所示。
的能量变化趋势如图所示。
(1)该反应为
(2)若要使该反应的反应速率加快,下列措施不可行的是___________(填字母)。
| A.将铁片改为铁粉 |
B.滴加少量 溶液 溶液 |
| C.升高温度 |
| D.将稀硫酸改为98%的浓硫酸 |
| A.碘水 | B.银氨溶液 | C.盐酸 | D. 溶液 溶液 |
(5)燃煤排放的尾气中含有二氧化硫、氮的氧化物(主要为
 )等污染物,工业上采用
)等污染物,工业上采用 碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为
碱性溶液作为吸收剂可同时对烟气进行脱硫、脱硝。脱硫的离子方程式为 ,
, 更难脱除,其原因可能是
更难脱除,其原因可能是
您最近一年使用:0次
7 . 为应对全球气候变化,早日实现“碳达峰”“碳中和”目标,研发 利用技术,降低空气中
利用技术,降低空气中 含量成为研究热点。
含量成为研究热点。
I.研究证明, 可作为合成低碳烯烃的原料,目前利用
可作为合成低碳烯烃的原料,目前利用 合成乙烯相关的热化学方程式如下:
合成乙烯相关的热化学方程式如下:
反应ⅰ: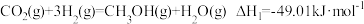
反应ⅱ:
反应ⅲ:
反应ⅳ:
(1)反应ⅰ为反应_____ (填“放热”或“吸热”),能正确表示该反应的图示是______ (填标号)。
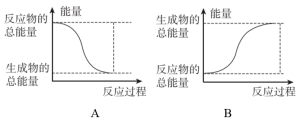
(2)计算可知∆H4=____ ,则利用反应ⅳ生产标准状况下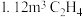 时,放出热量
时,放出热量_______ 。
II.具有广泛应用前景的新型 电化学储能系统吸引了广大科研工作者的研究兴趣。
电化学储能系统吸引了广大科研工作者的研究兴趣。 电池中,
电池中, 为单质锂片,该电池反应产物为碳酸锂和单质碳。
为单质锂片,该电池反应产物为碳酸锂和单质碳。
(3)则该电池中的 在
在___________ (填“正”或“负”)极发生电化学反应。
(4) 电池工作的总反应式为
电池工作的总反应式为___________ 。
III.可利用电还原方法将 转化成燃料。
转化成燃料。
(5) 在碱性介质中电还原为甲醇(
在碱性介质中电还原为甲醇( )的电极反应式为
)的电极反应式为___________ 。
 利用技术,降低空气中
利用技术,降低空气中 含量成为研究热点。
含量成为研究热点。I.研究证明,
 可作为合成低碳烯烃的原料,目前利用
可作为合成低碳烯烃的原料,目前利用 合成乙烯相关的热化学方程式如下:
合成乙烯相关的热化学方程式如下:反应ⅰ:
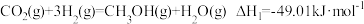
反应ⅱ:

反应ⅲ:

反应ⅳ:

(1)反应ⅰ为反应

(2)计算可知∆H4=
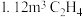 时,放出热量
时,放出热量II.具有广泛应用前景的新型
 电化学储能系统吸引了广大科研工作者的研究兴趣。
电化学储能系统吸引了广大科研工作者的研究兴趣。 电池中,
电池中, 为单质锂片,该电池反应产物为碳酸锂和单质碳。
为单质锂片,该电池反应产物为碳酸锂和单质碳。(3)则该电池中的
 在
在(4)
 电池工作的总反应式为
电池工作的总反应式为III.可利用电还原方法将
 转化成燃料。
转化成燃料。(5)
 在碱性介质中电还原为甲醇(
在碱性介质中电还原为甲醇( )的电极反应式为
)的电极反应式为
您最近一年使用:0次
名校
解题方法
8 . 某研究性学习小组为了证明铁的金属性比铜强,他们设计了如下几种方案,其中合理的是( )
| A.铁片置于硫酸铜溶液中置换出铜 |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2 |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解 |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
您最近一年使用:0次
2020-04-15更新
|
182次组卷
|
2卷引用:河北省张家口宣化一中2020-2021学年高一下学期4月月考化学试题
9 . 某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,_______ (填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3Fe(CN)6溶液,产生蓝色沉淀,说明溶液中含有Fe2+。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________ (用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测,同时发现有白色沉淀生成,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________ (用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______ 现象,判断溶液中存在Ag+,可产生Fe3+。
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
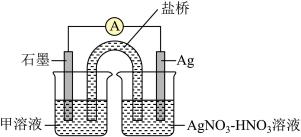
实验Ⅰ:向硝酸酸化的________ 溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________ ,操作及现象是________________ 。_______________ 。
(1)检验产物
①取出少量黑色固体,洗涤后,
②取上层清液,滴加K3Fe(CN)6溶液,产生蓝色沉淀,说明溶液中含有Fe2+。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测,同时发现有白色沉淀生成,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较30min时变浅 |
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的
实验Ⅱ:装置如图。其中甲溶液是
您最近一年使用:0次
2017-08-08更新
|
5126次组卷
|
22卷引用:河北省衡水中学2020年高中毕业班教学质量监测卷理科综合化学试题
河北省衡水中学2020年高中毕业班教学质量监测卷理科综合化学试题2017年全国普通高等学校招生统一考试理综化学(北京卷精编版)贵州省遵义航天高级中学2018届高三第一次模拟考试(9月月考)理科综合化学试题辽宁省实验中学分校2018届高三12月月考理科综合化学试题(已下线)《考前20天终极攻略》-5月27日 综合实验设计、探究和评价(已下线)解密18 物质的制备、实验方案的设计与评价——备战2018年高考化学之高频考点解密(已下线)考点07 元素化合物综合——《备战2020年高考精选考点专项突破题集》湖南长沙长郡中学2020届高三2月份网络教学质量监测卷理综化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题湖南省株洲市2020年高中毕业班教学质量监测卷理科综合化学试题(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)专题16 化学实验综合应用-备战2021届高考化学二轮复习题型专练(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题天津市西青区杨柳青第一中学2021--2022 学年高三上学期第一次阶段检测化学试题(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)北京市第四十三中学2021-2022学年高三上学期期中考试化学试题(已下线)题型48 实验原理探究型综合实验北京市中国人民大学附属中学2023-2024学年高三上学期期末考前化学练习 广东省广州市普通高中2024届高三下学期毕业班冲刺训练题(二)化学试题北京市第二十二中学2023-2024学年高一下学期期中考试化学试题
名校
10 . 银铝电池具有能量密度高的优点,其工作原理如图所示,电池放电时的反应为2Al+3Ag2O+2NaOH+3H2O=2Na[Al(OH)4]+6Ag。
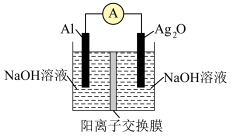
下列说法错误的是

下列说法错误的是
| A.Al为电源负极 | B.正极反应为Ag2O+2e-+H2O=2Ag+2OH- |
| C.放电时负极区pH增大 | D.放电时Na+通过交换膜向右侧移动 |
您最近一年使用:0次
2023-11-10更新
|
686次组卷
|
4卷引用:河北省定州市2023-2024学年高二上学期11月期中考试化学试题



