解题方法
1 . 海洋是人类未来赖以生存和发展的资源宝库,合理开发和有效利用应得到重视。如从海藻灰中可得到NaI溶液。
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有___________ 。
(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
①用CCl4萃取反应后I、II、III、IV 的溶液,萃取后下层CCl4均为无色,取萃取后的上层溶液,用淀粉检验:I、Ⅱ的溶液变蓝色;III的溶液蓝色不明显、Ⅳ的溶液未变蓝。
i.写出实验Ⅰ中反应的离子方程式___________ 。
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:
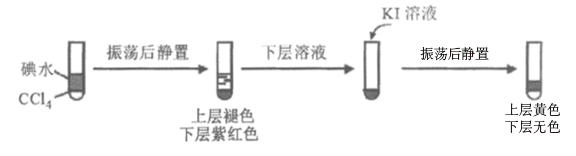
用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是___________ 。
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:
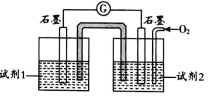
据此分析,试剂1是___________ ;试剂2是 ___________ 。
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为___________ 。
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++ +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。
①该实验达到滴定终点时,现象为___________ 。
②根据滴定有关数据,该NaI溶液中I—含量是___________ g·L-1。
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有

(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
| 实验 | 编号 | pH = a | 现象 |
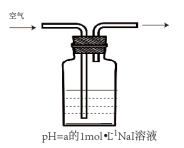 | I | 3 | 4分钟左右,溶液呈黄色 |
| Ⅱ | 7 | 60分钟左右,溶液呈浅黄色 | |
| Ⅲ | 8 | 10小时后,溶液呈很浅的黄色 | |
| Ⅳ | 10 | 10小时后,溶液颜色无明显变化 |
i.写出实验Ⅰ中反应的离子方程式
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:

用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:

据此分析,试剂1是
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++
 +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。①该实验达到滴定终点时,现象为
②根据滴定有关数据,该NaI溶液中I—含量是
您最近一年使用:0次
名校
2 . 相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:
资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3- Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21
(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为___________ ,B的作用为___________ 。
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是___________ 。
(3)D中用NaOH溶液进行尾气处理,存在的问题是___________ 、___________ 。
(实验2)通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。
(4)取实验2中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红,说明晶体中含有+3价的铁元素。加硫酸后溶液变红的原因是___________ 。
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是___________ 。
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:___________ [Fe(C2O4)3]3-
___________ FeC2O4↓+___________ ↑+___________
(实验3)又设计以下装置直接比较Fe2+和C2O 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
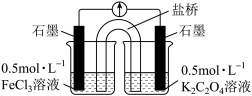
(7)描述达到预期目的可能产生的现象:___________ 。
 )的还原性强于Fe2+。为检验这一结论,进行以下实验:
)的还原性强于Fe2+。为检验这一结论,进行以下实验:资料:i.工业上,向炽热铁屑中通入氯化氢生产无水氯化亚铁。
ii.K3[Fe(C2O4)3]・3H2O(三草酸合铁酸钾)为亮绿色晶体,光照易分解。其水溶液中存在[Fe(C2O4)3]3-
 Fe3++3C2O
Fe3++3C2O K=6.3×10-21
K=6.3×10-21(实验1)用以下装置制取无水氯化亚铁

(1)仪器a的名称为
(2)欲制得纯净的FeCl2,实验过程中点燃A、C酒精灯的先后顺序是
(3)D中用NaOH溶液进行尾气处理,存在的问题是
(实验2)通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱。
的还原性强弱。操作 | 现象 |
| 在避光处,向10mL 0.5 mol·L-1FeCl3溶液中缓慢加入0.5 mol·L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到亮绿色溶液和亮绿色晶体 |
(5)经检验,亮绿色晶体为K3Fe(C2O4)3・3H2O。设计实验,确认实验2中没有发生氧化还原反应的操作和现象是
(6)取实验2中的亮绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:

(实验3)又设计以下装置直接比较Fe2+和C2O
 的还原性强弱,并达到了预期的目的。
的还原性强弱,并达到了预期的目的。
(7)描述达到预期目的可能产生的现象:
您最近一年使用:0次
2020-12-11更新
|
1229次组卷
|
4卷引用:培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)
(已下线)培优01 无机制备类实验 基础训练-2021年高考化学大题培优练(新高考地区专用)黑龙江省哈尔滨市第三中学2021届高三上学期第四次验收考试化学试题黑龙江省哈尔滨市第九中学2021届高三上学期第四次验收化学试卷重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题
解题方法
3 . 习近平总书记在科学家座谈会上指出“好奇心是人的天性,对科学兴趣的引导和培养要从娃娃抓起”。某化学兴趣小组为培养同学们对科学探究的兴趣,设计图1所示实验来探究 与Cu2+的反应:
与Cu2+的反应:

已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:
(1)若用CuSO4·5H2O配制100 mL 1 mol/LCuSO4溶液,需用托盘天平称取CuSO4·5H2O的质量为___________ 。甲同学在定容时采用上图2方式观察,则所配制的CuSO4溶液浓度___________ (填“偏高”或“偏低”)。
(2)将操作2后生成的无色气体通入氯化铁溶液,___________ (填实验现象),说明该气体为SO2,反应的离子方程式为___________ 。
(3)操作2后生成的白色沉淀为___________ (填化学式),生成该沉淀和无色气体的反应离子方程式为___________ 。
(4)根据氧化还原反应的规律,乙同学推测操作2中涉及 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于
与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于 ,用图3装置(a、b均为石墨电极)进行实验验证。
,用图3装置(a、b均为石墨电极)进行实验验证。

①K闭合时,一段时间后指针几乎归零。
②向U形管右管添加___________ ,a电极为___________ 极,产生的现象证实了其推测,其中不同于图1操作2后的现象是___________ 。
(5)基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与___________ 有关。该同学用图3装置再次进行实验,以丰富验证该猜想的证据。与(4)实验对比,不同的操作是向U形管左管添加___________ 。
 与Cu2+的反应:
与Cu2+的反应:
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水
回答下列问题:
(1)若用CuSO4·5H2O配制100 mL 1 mol/LCuSO4溶液,需用托盘天平称取CuSO4·5H2O的质量为
(2)将操作2后生成的无色气体通入氯化铁溶液,
(3)操作2后生成的白色沉淀为
(4)根据氧化还原反应的规律,乙同学推测操作2中涉及
 与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于
与Cu2+的可逆反应正向进行的原因:外加Cl-导致Cu+的还原性弱于 ,用图3装置(a、b均为石墨电极)进行实验验证。
,用图3装置(a、b均为石墨电极)进行实验验证。
①K闭合时,一段时间后指针几乎归零。
②向U形管右管添加
(5)基于(4)实验,乙同学得出进一步猜想:物质的氧化性和还原性与
您最近一年使用:0次
名校
解题方法
4 . 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
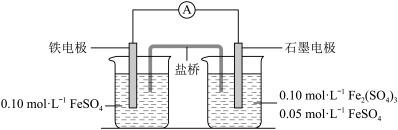
回答下列问题:
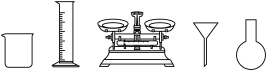
(1)由FeSO4·7H2O固体配制0.10 mol·L-1FeSO4溶液,需要的仪器有药匙、玻璃棒、________ (从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择________ 作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________ 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________ 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为________ ,铁电极的电极反应式为______________ 。因此,验证了Fe2+氧化性小于Fe3+还原性小于Fe。

回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L-1FeSO4溶液,需要的仪器有药匙、玻璃棒、

(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择
| 阳离子 | u∞×108/(m2·s-1·V-1) | 阴离子 | u∞×108/(m2·s-1·V-1) |
| Li+ | 4.07 |  | 4.61 |
| Na+ | 5.19 |  | 7.40 |
| Ca2+ | 6.59 | Cl- | 7.91 |
| K+ | 7.62 |  | 8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为
您最近一年使用:0次
2021-01-12更新
|
135次组卷
|
2卷引用:新疆伊犁奎屯市第一高级中学2020-2021学年高二上学期期末考试化学试题
解题方法
5 . 浓差电池有多种:一种是利用物质氧化性或还原性强弱与浓度的关系设计的原电池(如图1):一种是根据电池中存在浓度差会产生电动势而设计的原电池(如图2)。图1所示原电池能在一段时间内形成稳定电流;图2所示原电池既能从浓缩海水中提取LiCl,又能获得电能。下列说法错误的是


| A.图1电流计指针不再偏转时,左右两侧溶液浓度恰好相等 |
| B.图1电流计指针不再偏转时向左侧加入NaCl或AgNO3或Fe粉,指针又会偏转且方向相同 |
| C.图2中Y极每生成1 mol Cl2,a极区得到2 mol LiCl |
| D.两个原电池外电路中电子流动方向均为从右到左 |
您最近一年使用:0次
名校
6 . 实验室用浓硫酸、铜与NaOH溶液为原料制取少量 并探究其性质。
并探究其性质。
I.制备 (装置如图所示)。
(装置如图所示)。
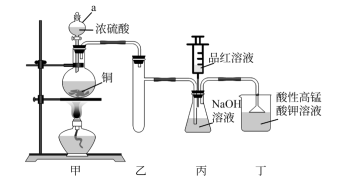
(1)仪器a的名称是___________ 。
(2)装置丁的作用有①吸收尾气,防止环境污染;②___________ ;③___________ 。
(3)证明丙中NaOH已完全转化为 的操作和现象是
的操作和现象是___________ 。
II.探究 与
与 的反应,设计实验如下:向2mL1mol/L
的反应,设计实验如下:向2mL1mol/L 溶液中加入2mL1mol/L
溶液中加入2mL1mol/L 溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。
溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。
(4)推测实验Ⅱ产生的无色气体为 ,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到
,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到___________ ,反应的离子方程式为___________ 。
(5)对实验Ⅱ产生 的原因进行分析,提出两种假设:
的原因进行分析,提出两种假设:
假设1: 水解使溶液中
水解使溶液中 增大。
增大。
假设2: 存在时,
存在时, 与
与 反应生成CuCl白色沉淀,溶液中
反应生成CuCl白色沉淀,溶液中 增大。
增大。
①假设1不合理,实验证据是___________ 。
②实验证实假设2合理,实验Ⅱ中发生反应的离子方程式有______ ,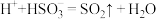 。
。
(6)通过上述分析可知, 增强了
增强了 的氧化性。某同学设计原电池实验证明该实验结果。
的氧化性。某同学设计原电池实验证明该实验结果。
①补全乙实验的现象___________ 。
②已知E为电池电动势[电池电动势即电池的理论电压,是两个电极电位之差,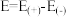 ],
],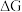 为电池反应的自由能变,则甲电池与乙电池相比较,
为电池反应的自由能变,则甲电池与乙电池相比较,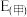
___________ 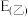 ,
,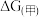
___________ 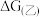 (填“>”或“<”)。
(填“>”或“<”)。
 并探究其性质。
并探究其性质。I.制备
 (装置如图所示)。
(装置如图所示)。
(1)仪器a的名称是
(2)装置丁的作用有①吸收尾气,防止环境污染;②
(3)证明丙中NaOH已完全转化为
 的操作和现象是
的操作和现象是II.探究
 与
与 的反应,设计实验如下:向2mL1mol/L
的反应,设计实验如下:向2mL1mol/L 溶液中加入2mL1mol/L
溶液中加入2mL1mol/L 溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。
溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份,进行实验Ⅰ和Ⅱ。| 实验 | 操作及现象 |
| Ⅰ | 加入适量 固体,瞬间无明显变化,30s时也无明显变化。 固体,瞬间无明显变化,30s时也无明显变化。 |
| Ⅱ | 加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀,上层溶液颜色变浅。 |
 ,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到
,实验证实推测正确:用滴有碘水的淀粉试纸接近试管口,观察到(5)对实验Ⅱ产生
 的原因进行分析,提出两种假设:
的原因进行分析,提出两种假设:假设1:
 水解使溶液中
水解使溶液中 增大。
增大。假设2:
 存在时,
存在时, 与
与 反应生成CuCl白色沉淀,溶液中
反应生成CuCl白色沉淀,溶液中 增大。
增大。①假设1不合理,实验证据是
②实验证实假设2合理,实验Ⅱ中发生反应的离子方程式有
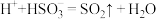 。
。(6)通过上述分析可知,
 增强了
增强了 的氧化性。某同学设计原电池实验证明该实验结果。
的氧化性。某同学设计原电池实验证明该实验结果。①补全乙实验的现象
| 编号 | 甲 | 乙 |
| 实验 | 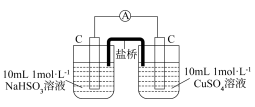 | 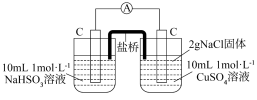 |
| 现象 | 电流计指针发生微小偏转 |
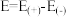 ],
],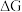 为电池反应的自由能变,则甲电池与乙电池相比较,
为电池反应的自由能变,则甲电池与乙电池相比较,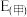
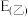 ,
,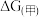
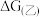 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
解题方法
7 . I.原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
(1)装置甲中 向
向___________ 极移动(填“A”或“B”);
(2)四种金属活动性由强到弱的顺序是___________ ;
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为___________ mol。
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的___________ 极,X极的电极反应方程式为___________ ,电路中每转移0.2mol电子,标准状况下正极上消耗气体的体积是___________ L。
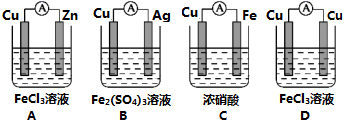
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是___________ 。
(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O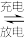 Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是___________ (填物质化学式),该电极质量___________ (填“增加”或“减少)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到___________ mol/L。
| 装置 |  |  | 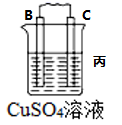 |
| 现象 | B上有气体产生 | D不断溶解 | C质量增加 |
(1)装置甲中
 向
向(2)四种金属活动性由强到弱的顺序是
(3)若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g.则导线中通过电子的物质的量为
II.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下图为甲烷燃料电池的构造示意图,由此判断

Y极为电池的
(2)为了验证Fe3+与Cu2+氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O
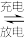 Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
Pb +PbO2+2H2SO4.铅蓄电池放电时正极是
您最近一年使用:0次
解题方法
8 . 为验证元素金属性和非金属性强弱,某兴趣小组的同学设计下列两组实验。请回答下列问题:
实验一:验证卤族元素氯、溴、碘的非金属性强弱。
(1)步骤3的实验现象是_______ 。
(2)步骤1中加入过量氯水对实验结果_______ (填“有”或“无”)影响,解释原因_______ 。
(3)根据实验结果判断氯、溴、碘单质的氧化性由强到弱的顺序为_______ (用化学式表示)。
实验二:为验证Mg、Al金属性的强弱,设计如下实验。

根据表中的实验现象回答下列问题:
(4)实验Ⅰ中电池工作时电解质溶液中 移向
移向_______ (填“Mg”或“石墨”)电极。
(5)根据实验_______ (填实验编号)可判断Mg、Al两种元素的金属性强弱。
(6)实验Ⅲ中电流表指针偏向Mg的原因是_______ ;该电池负极的电极反应式为_______ 。
实验一:验证卤族元素氯、溴、碘的非金属性强弱。
| 步骤1 | 步骤2 | 步骤3 | |
| 实验 | 向 的 的 溶液中滴加少量氯水,振荡 溶液中滴加少量氯水,振荡 | 继续加入 的KI溶液,振荡后加入 的KI溶液,振荡后加入 ,继续振荡 ,继续振荡 | 另取 的KI溶液,滴加氯水,加入 的KI溶液,滴加氯水,加入 ,振荡 ,振荡 |
(2)步骤1中加入过量氯水对实验结果
(3)根据实验结果判断氯、溴、碘单质的氧化性由强到弱的顺序为
实验二:为验证Mg、Al金属性的强弱,设计如下实验。
| 编号 | 电极材料 | 电解质溶液 | 电流表指针 |
| Ⅰ | Mg、石墨 | 稀 | 偏向石墨 |
| Ⅱ | Mg、Al | 稀 | 偏向Al |
| Ⅲ | Mg、Al |  溶液 溶液 | 偏向Mg |

根据表中的实验现象回答下列问题:
(4)实验Ⅰ中电池工作时电解质溶液中
 移向
移向(5)根据实验
(6)实验Ⅲ中电流表指针偏向Mg的原因是
您最近一年使用:0次
2021-05-07更新
|
153次组卷
|
2卷引用:河南名校联盟2020-2021学年高一下学期期中考试化学试题
9 . 电化学是当今化学研究的热点之一,回答下列问题:
(1)碱性电池具有耐用、电流量大、储存寿命长、外壳不易腐蚀等优点。铝-铜碱性原电池的工作原理如装置甲所示:
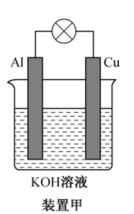
①在_______ (“Al”或“Cu”)极有H2生成,Al极电极反应式为_______ 。
②若有33.6 L(标准状况下)H2生成,则理论上电解质溶液增重_______ g。
(2)某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解NaCl溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
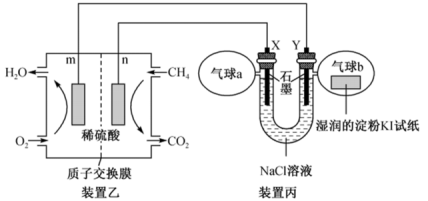
①m极为_______ 极,装置乙发生反应的化学方程式为_______ 。
②Y极电极反应式为_______ 。
③气球b中的现象为_______ 。
(1)碱性电池具有耐用、电流量大、储存寿命长、外壳不易腐蚀等优点。铝-铜碱性原电池的工作原理如装置甲所示:

①在
②若有33.6 L(标准状况下)H2生成,则理论上电解质溶液增重
(2)某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解NaCl溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。

①m极为
②Y极电极反应式为
③气球b中的现象为
您最近一年使用:0次
名校
解题方法
10 . 某同学研究FeSO4溶液和AgNO3溶液的反应,设计如下对比实验。
下列说法正确的是
| 实验 |  Ⅰ |  Ⅱ |
| 现象 | 连通电路后,电流表指针向右偏转,分别取反应前和反应一段时间后甲烧杯中的溶液,滴加KSCN溶液,前者几乎无色,后者显红色 | 连通电路后,电流表指针向左发生微小的偏转,丙、丁烧杯中均无明显现象 |
下列说法正确的是
| A.仅由Ⅰ中的现象可推知Ag+的氧化性强于Fe3+ |
| B.Ⅱ中电流表指针向左偏转的原因是Fe2+氧化了银电极 |
| C.Ⅱ中若将银电极换成石墨电极,电流表指针可能不再向左偏转 |
| D.对比Ⅰ、Ⅱ可知,Ⅰ中NO3-氧化了Fe2+ |
您最近一年使用:0次
2020-06-11更新
|
3817次组卷
|
8卷引用:北京市房山区2020-2021学年高二上学期期末考试化学试题



