名校
解题方法
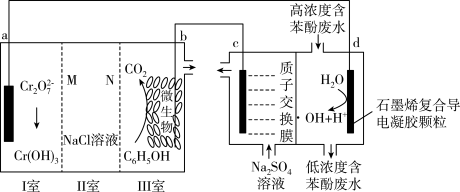
1 . 我国科学家设计了一种利用废水中的 将苯酚氧化为
将苯酚氧化为 和
和 的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基(
的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基( )的氧化性仅次于氟气。下列说法正确的是
)的氧化性仅次于氟气。下列说法正确的是
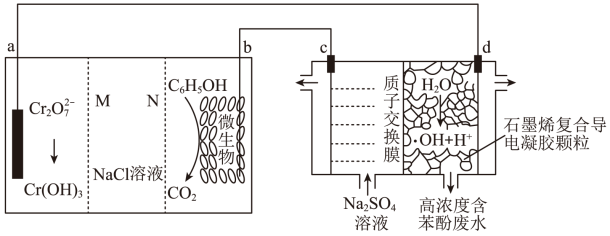
 将苯酚氧化为
将苯酚氧化为 和
和 的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基(
的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基( )的氧化性仅次于氟气。下列说法正确的是
)的氧化性仅次于氟气。下列说法正确的是
| A.电子转移方向:c电极→导线→b电极 |
B.d电极的电极反应为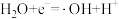 |
C.右侧装置中,c、d两电极产生气体的体积比(相同条件下)为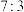 |
D.若a电极上有 参与反应,理论上 参与反应,理论上 溶液中有 溶液中有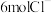 通过阴离子膜进入a电极区溶液 通过阴离子膜进入a电极区溶液 |
您最近一年使用:0次
2023-05-04更新
|
299次组卷
|
2卷引用:河北省石家庄部分重点高中2022-2023学年高三下学期3月月考化学试题
名校
2 . 羟基自由基( )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
 )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
| A.a极为正极,c极为阴极 |
B.a极区每产生1mol ,c极区溶液质量减轻3g ,c极区溶液质量减轻3g |
C.d极的电极反应式为 |
D.工作时,如果II室中 、 、 数目都减小,则N为阴离子交换膜 数目都减小,则N为阴离子交换膜 |
您最近一年使用:0次
2022-12-24更新
|
698次组卷
|
4卷引用:河北省衡水市2022-2023学年高三上学期12月份大联考化学试卷
河北省衡水市2022-2023学年高三上学期12月份大联考化学试卷广东省部分学校2022-2023学年高三上学期12月大联考化学试题辽宁省沈阳市第二中学2022-2023学年高三上学期期末考试化学试题 (已下线)专题一 原电池的工作原理及其应用(练习)
名校
解题方法
3 . 为研究碘的化合物氧化性强弱设计如图实验,①、②实验左侧烧杯中溶液颜色都变蓝,下列说法中错误的是
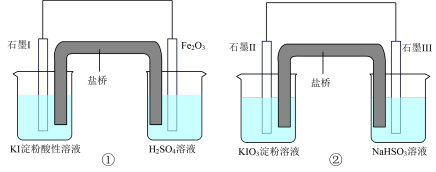

| A.①中Fe2O3极的电极反应式为Fe2O3+2e- + 6H+=2Fe2+ +3H2O |
| B.碘元素在装置①中被氧化,在装置②中被还原 |
| C.两装置的盐桥中阳离子都向含碘化合物烧杯中移动 |
| D.装置①、②中生成等量的I2时,导线上通过的电子数之比为1∶5 |
您最近一年使用:0次
2022-02-20更新
|
164次组卷
|
3卷引用:河北省石家庄市第二中学2021-2022学年高一下学期3月月考化学试题
名校
解题方法
4 . 某研究性学习小组的同学对 、
、 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
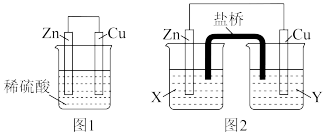
(1)实验表明,图1中铜电极上有气泡产生,说明反应中有一部分化学能转化为___________ 能。锌电极为___________ 极(填写“正”或“负”),电极反应为:___________
(2)图2中实验过程中只有Cu极上产生气泡,则X是_______ 溶液,正极上的电极反应式为_______ 。
(3)当图1装置中的溶液质量增加63g时,生成氢气_______ L(标准状况);当图2中锌电极的质量减少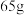 时,电路中转移的电子为
时,电路中转移的电子为_______  。
。
 、
、 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
(1)实验表明,图1中铜电极上有气泡产生,说明反应中有一部分化学能转化为
(2)图2中实验过程中只有Cu极上产生气泡,则X是
(3)当图1装置中的溶液质量增加63g时,生成氢气
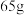 时,电路中转移的电子为
时,电路中转移的电子为 。
。
您最近一年使用:0次
5 . 如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____ (填“正极”或“负极”),通氢气一极的电极反应式为_________________ ;
(2)铁电极为_______ (填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________ 。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______ g;
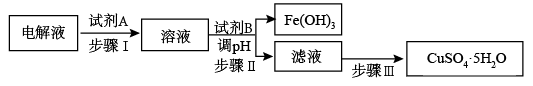
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:
已知:几种金属阳离子开始沉淀和沉淀完全的pH:
①步骤I中加入试剂A的目的是_____________________________ ,试剂A应选择______ (填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________ ;
②步骤II中试剂B为_________ ,调节pH的范围是___________ ;
③步骤III的操作是加热浓缩、_______ 、___________ 。

(1)通入氧气的电极为
(2)铁电极为
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因
②步骤II中试剂B为
③步骤III的操作是加热浓缩、
您最近一年使用:0次
2018-01-27更新
|
689次组卷
|
4卷引用:河北省张家口市2017-2018学年高二上学期期末考试化学试题
名校
6 . 以肼 为燃料、空气为助燃剂可设计碱性燃料电池,其工作原理如图所示。该电池的优势是能源转化率高,且产物无污染。下列说法错误的是
为燃料、空气为助燃剂可设计碱性燃料电池,其工作原理如图所示。该电池的优势是能源转化率高,且产物无污染。下列说法错误的是
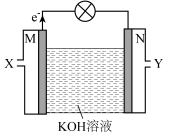
 为燃料、空气为助燃剂可设计碱性燃料电池,其工作原理如图所示。该电池的优势是能源转化率高,且产物无污染。下列说法错误的是
为燃料、空气为助燃剂可设计碱性燃料电池,其工作原理如图所示。该电池的优势是能源转化率高,且产物无污染。下列说法错误的是
| A.空气由Y口通入 |
B.M极的电极反应为 |
C.电池的总反应为 |
| D.电池工作时,溶液的pH增大 |
您最近一年使用:0次
2024-01-15更新
|
431次组卷
|
2卷引用:河北省沧州市部分学校2023-2024学年高三上学期12月联考化学试题
解题方法
7 . 化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是_____ (填字母,下同)。
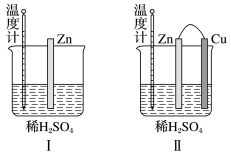
(2)为了探究化学反应中的能量变化,某同学设计了如图两个实验(如图)。有关反应一段时间后的实验现象,下列说法正确的是_____ 。
(3)电动汽车上用的铅蓄电池是以一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时正极的电极反应式:______ 。
②铅蓄电池放电时,负极质量将_____ (填“增大”“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为______ 。
(4)某种CH3OH燃料电池由甲醇、空气(氧气)、KOH溶液(电解质溶液)构成。其中负极反应式为_____ 。下列说法正确的是_____ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是
| A.KOH+HCl=KCl+H2O | B.Cu+2Fe3+=2Fe2++Cu2+ |
| C.Cu+H2SO4=CuSO4+H2↑ | D.Na2O+H2O=2NaOH |

| A.图I和图II的气泡均产生于锌棒表面 |
| B.图I中温度计的示数高于图II的示数 |
| C.图I和图II中温度计的示数相等,且均高于室温 |
| D.图II中产生气体的速率比I慢 |
①写出放电时正极的电极反应式:
②铅蓄电池放电时,负极质量将
(4)某种CH3OH燃料电池由甲醇、空气(氧气)、KOH溶液(电解质溶液)构成。其中负极反应式为
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
您最近一年使用:0次
解题方法
8 . 根据化学能转化为电能的相关知识,回答下列问题:
I.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是____ ,发生____ (填“氧化”或”还原”)反应,电解质溶液是____ 。
(2)正极上出现的现象是____ 。
II.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图:
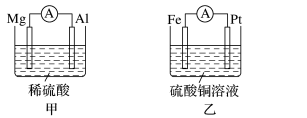
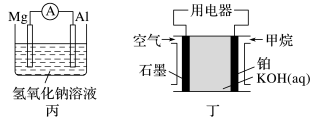
(3)丙装置中负极反应式为____ ,丁装置中负极反应式为____ 。
(4)电池的放电过程中,甲装置中溶液质量____ (填“增加”或“减少”);丁装置中溶液碱性____ (填“增强”或减弱”)。
(5)当甲装置导线中转移0.3mol电子时,正极生成气体____ L(标准状况下);假设开始时乙装置中两电极质量相等,导线中转移0.3mol电子时,两电极质量相差____ g。
I.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是
(2)正极上出现的现象是
II.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图:


(3)丙装置中负极反应式为
(4)电池的放电过程中,甲装置中溶液质量
(5)当甲装置导线中转移0.3mol电子时,正极生成气体
您最近一年使用:0次
名校
解题方法
9 . 形形色色的电池在生产生活中有着重要的作用,请回答下列问题:
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,总反应为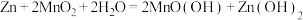 。该电池的正极为
。该电池的正极为__________ (填“Zn”或“ ”),其电极反应式为
”),其电极反应式为__________ 。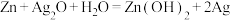 ,放电时,
,放电时, 发生
发生__________ (填“氧化”或“还原”)反应。一种废旧纽扣电池回收工艺流程如图所示,稀硫酸溶解时需要在无氧环境下进行,原因是__________ ;加入稀硝酸溶解银时,产物为 、NO和
、NO和 ,该反应的化学方程式为
,该反应的化学方程式为__________ ,调浆后,加入葡萄糖制备银粉,葡萄糖的作用为__________ 。__________ ,电路中每转移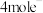 ,两极共消耗
,两极共消耗__________ L(换算成标准状况下)气体。
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,总反应为
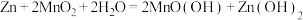 。该电池的正极为
。该电池的正极为 ”),其电极反应式为
”),其电极反应式为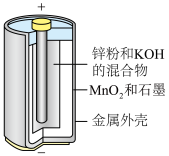
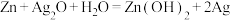 ,放电时,
,放电时, 发生
发生 、NO和
、NO和 ,该反应的化学方程式为
,该反应的化学方程式为
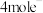 ,两极共消耗
,两极共消耗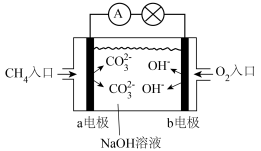
您最近一年使用:0次
2024-03-27更新
|
432次组卷
|
3卷引用:河北省沧州市沧县中学等校2023-2024学年高一下学期3月联考化学试题
2022·黑龙江哈尔滨·三模
名校
解题方法
10 . 某科研小组设计双阴极微生物燃料电池进行同步硝化和反硝化脱氮研究,装置如图所示。下列叙述错误的是
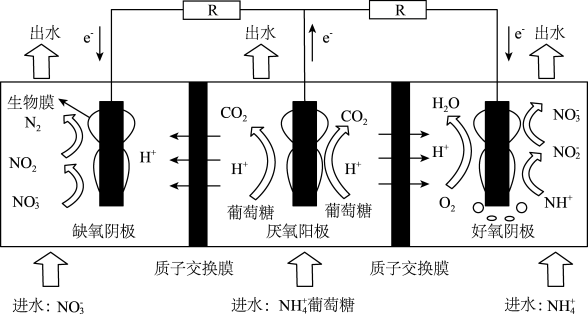

| A.“厌氧阳极”的电极反应方程式为 C6H12O6+6H2O - 24e -=6CO2+24H+ |
| B.电池工作时,“缺氧阴极”电极附近的溶液pH增大 |
C.该电池工作中“好氧阴极”和“缺氧阴极”之间存在着对电子的竞争作用, 和电极之间存在着对O2的竞争 和电极之间存在着对O2的竞争 |
D.若“好氧阴极”1mol 完全生成 完全生成 ,此时向该电极输送电子的物质的量为4mol,则该区消耗的O2在标准状况的体积约为44.8L ,此时向该电极输送电子的物质的量为4mol,则该区消耗的O2在标准状况的体积约为44.8L |
您最近一年使用:0次
2022-04-20更新
|
1309次组卷
|
9卷引用:化学-2022年高考考前押题密卷(河北卷)
(已下线)化学-2022年高考考前押题密卷(河北卷)黑龙江省哈尔滨市第九中学2022届高三下学期第三次模拟考试理综化学试题(已下线)专项11 电化学基础-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)押全国卷理综第11题 电化学基础-备战2022年高考化学临考题号押题(课标全国卷)陕西省部分地市学校2022届高三全真模拟考试理科综合试卷化学试题(已下线)微专题32 电化学中的交换膜-备战2023年高考化学一轮复习考点微专题湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题湖南省常德市汉寿县第一中学2022届高三下学期第三次模考化学试题进阶训练9



